Nombre stérique
En chimie, le nombre stérique ou nombre de doublets d'une molécule est le nombre d'atomes liés à l'atome central de la molécule, additionné du nombre de doublets non-liants sur ce même atome. Il est souvent utilisé dans la théorie VSEPR (« valence shell electron-pair repulsion theory ») afin de déterminer la forme d'une molécule, ou plus précisément sa géométrie moléculaire.
Nombre stérique en théorie VSEPR[modifier | modifier le code]
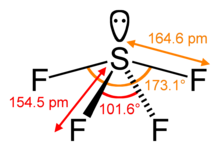
Calculer le nombre stérique de l'atome central d'une molécule est une étape-clé pour prédire sa géométrie selon la théorie VSEPR. Dans la molécule de tétrafluorure de soufre par exemple, l'atome central de soufre possède quatre ligands autour de lui, en considérant son coordinence. En plus de ces quatre ligands, le soufre possède un double non-liant (le soufre n'est pas hypervalent dans ce composé). De ce fait, son nombre stérique est 5. ce nombre connu, ainsi que celui des doublets non-liants, il est possible de prédire la géométrie de l'atome central par la théorie VSEPR. Dans ce cas particulier, nous avons un nombre stérique de 5, et 1 doublet non-liant : la géométrie de l'atome central sera de type balançoire (la méthode AXE donne quant à elle AX4E1)
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Steric number » (voir la liste des auteurs).
