Utilisateur:Prepapc/Chimie/Organique








La liaison double C=C[modifier | modifier le code]
Hydrogénation[modifier | modifier le code]
Conditions opératoires[modifier | modifier le code]
- Dérivés éthyléniques
- Conditions : H2 à 3 bars
- Catalyseur : Pt, Pd, Ni → alcane
- Aromatiques
- Conditions : H2 à 100 bars, T > 500°C
- Alcynes
- Conditions : H2 à 3 bars
- Catalyseur : Pt, Pd, Ni → alcane
- Catalyseur : Pd de Lindlar (« empoisonné » à l'oxyde ou à l'acétate de plomb) → alcène
- Carbonyles
- Température : 80-200°C
- H2 5-30 bars
- Catalyseur : Ni → alcool
Étapes[modifier | modifier le code]
- Diffusion des réactifs vers la surface du catalyseur
- Adsorption des réactifs sur le catalyseur
- Réaction à la surface
- Désorption des produits
- Diffusion loin de la surface
Époxydation/hydrolyse[modifier | modifier le code]
- Action peracide sur C=C → époxyde
- Attaque C=C plus riche en e-(si plusieurs C=C)
- Hydrolyse acide(H+) / basique(HO-) donne alcool
Bilan :
- Anti-dihydroxylation sur C=C → diol vicinal
- Diastéréospécifique
Ozonolyse[modifier | modifier le code]
Réductrice[modifier | modifier le code]
- Solvant : Dichlorométhane : CH2Cl2
- Catalyseurs (?) : acide éthanoïque CH3COOH, Zn
- Bilan : cétones (R-(C=O)-R’) + aldéhydes (R-(C=O)-H)
Oxydante[modifier | modifier le code]
- Solvant : Diméthylsulfate (DMS) : CH3-S-CH3
- Catalyseurs (?) : CH3COOH, Zn
- Bilan : cétones (R-(C=O)-R’) + aldéhydes (R-(C=O)-H) + DMSO (diméthylsulfoxyde) : CH32
- Mêmes résultats avec solution chaude et concentrée de KMnO4
Tétraoxyde d'Osmium[modifier | modifier le code]
Bilan :
- Syn-dihydroxylation sur C=C
- Stéréospécifique
- Os passe du degré d’oxydation +VIII à +VI
- Mêmes résultats avec solution neutre et diluée de KMNO4
Hydroboration[modifier | modifier le code]

H-BH2 avec lacune électronique sur B
C=C attaque la lacune et H-B attaque C le plus encombré ce qui forme H-C-C-B-H2
On itère encore 2 fois et on a : (H-C-C)2 à la place de H2 sur B.
Oxydation du trialkylborane : 3 trialkylboranes + 3H2O2+ 3 HO- = 3 alcools + BO33- + 3H2O
Donne composé anti-Markovnikov (≠ hydrolyse acide)
Additions nucléophiles sur les composés carbonylés[modifier | modifier le code]
Carbonyles énolisables[modifier | modifier le code]
- Contrôle orbitalaire :
- Contrôle cinétique :
Réactivité α-énone[modifier | modifier le code]
- R-Li →
- R2CuLi →
- R-Mg-X → Mélange ;
Condensation aldolique[modifier | modifier le code]
Aldolisation[modifier | modifier le code]
Crotonisation[modifier | modifier le code]
Crotonisation acide[modifier | modifier le code]

Crotonisation basique[modifier | modifier le code]
Acides carboxyliques et dérivés d'acide[modifier | modifier le code]
Nomenclature[modifier | modifier le code]
HOOC-CH2COOH : acide propanedioïque (malonique)
RMN[modifier | modifier le code]
pKA[modifier | modifier le code]
Acide faible
Synthèse des esters[modifier | modifier le code]
À partir d'un alcool[modifier | modifier le code]
On chauffe (raisons cinétique). On ajoute un catalyseur (H+ sous forme H2SO4)
- Alcool Iaires :
- Alcool IIaires :
- Alcool IIIaires :
Synthèse des amides[modifier | modifier le code]
- À partir d'un acide carboxylique activé et d'une amine, comme par exemple :
- chlorure d'acyle R-CO-Cl et libération de chlorure d'hydrogène H-Cl, piégé par l'amine
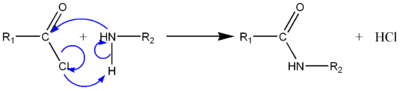
Le chlorure d'hydrogène (HCl) produit peut être neutralisé par l'amine mais également par l'ajout d'un capteur de proton comme la pyridine par exemple. - anhydride d'acide R-CO-O-CO-R et libération d'acide carboxylique, qui réagit avec un deuxième équivalent de l'amine

L'acide produit n'est pas assez réactif pour former un amide avec l'amine.
- chlorure d'acyle R-CO-Cl et libération de chlorure d'hydrogène H-Cl, piégé par l'amine
Synthèse malonique[modifier | modifier le code]
Intérêt :
- Transformer R-X en R-CH2COOH













