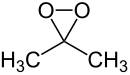
Diméthyldioxirane
| Diméthyldioxirane | |
   |
|
| Identification | |
|---|---|
| Nom UICPA | diméthyldioxirane |
| Synonymes |
DMDO |
| No CAS | |
| PubChem | 115197 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C3H6O2 [Isomères] |
| Masse molaire[1] | 74,078 5 ± 0,003 4 g/mol C 48,64 %, H 8,16 %, O 43,2 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le diméthyldioxirane (DMDO) est un dioxirane dérivé de l'acétone. C'est le seul dioxirane d'usage courant, c'est un réactif utilisé en synthèse organique.
Synthèse
[modifier | modifier le code]Le DMDO n'est pas disponible commercialement du fait de son instabilité. Il peut être préparé par la réaction de l'acétone avec l'oxone dans lequel l'hydrogénopersulfate de potassium est la substance active[2] :
La préparation du DMDO est très peu efficace (rendement typique < 3 %) et pratiquement ne fournit qu'une solution diluée dans l'acétone (env. 0,15 M). Cependant, c'est sans conséquence puisqu'aussi bien le DMDO est préparé avec des réactifs de départ extrêmement peu chers : acétone, bicarbonate de sodium, hydrogénopersulfate de potassium (connu commercialement comme l'oxone). Une solution fraîche de DMDO dans l'acétone peut se conserver une à deux semaines au freezer. Des titrations avant usage sont indispensables (typiquement par RMN 1H avec du thioanisole).
Utilisation
[modifier | modifier le code]L'usage le plus commun du DMDO est l'oxydation d'alcènes en époxydes. L'un des avantages particulier du DMDO est que le seul coproduit de l'oxydation est de l'acétone, un composé peu toxique et volatil. Les oxydations au DMDO sont particulièrement douces, permettant occasionnellement des oxydations impossibles à effectuer par d'autres voies. En fait, le diméthyldioxirane est considéré comme le réactif de choix pour les époxydations et est presque dans toutes les circonstances aussi bon sinon meilleur que d'autres peracides comme l'acide méta-chloroperbenzoïque (m-CPBA).
En dépit de sa haute réactivité, le DMDO montre une bonne sélectivité sur les oléfines. Typiquement, les alcènes déficitaires en électron sont oxydés plus lentement que ceux riches en électron. Le DMDO peut aussi oxyder d'autres groupes fonctionnels. Par exemple, le DMDO oxyde les amines primaires en composés nitro et les sulfures (thioéthers) en sulfoxydes et ceux-ci en sulfones. Dans certains cas, Le DMDO est même capable d'oxyder une liaison C-H inactivée:
Le DMDO peut aussi être utilisé pour convertir des composés nitro en composés carbonyle (réaction de Nef):
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dimethyldioxirane » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Robert W. Murray and Megh Singh, Synthesis of epoxides using dimethyldioxirane: trans-stilbene oxide], Org. Synth., coll. « vol. 9 », , p. 288
- (en) Dimethyldioxirane. Crandall, J.K.; Curci, R.; D'Accolti, L.; Fusco, C.; Encyclopedia of Reagents for Organic Synthesis (2005). DOI 10.1002/047084289X.rd329.



