Хром
Хром — хімічний елемент, із символом Cr і атомним номером 24, перший елемент шостої групи.
Історія[ред. | ред. код]
У 1766 році в околицях Єкатеринбурга був виявлений мінерал, який отримав назву «сибірський червоний свинець», PbCrO4. Сучасна назва — крокоїт. У 1797 французький хімік Л. Н. Воклен виділив з нього новий тугоплавкий метал (найімовірніше Воклен отримав карбід хрому).
Походження назви[ред. | ред. код]
Назва походить від грец. χρωμα — «колір», завдяки яскравій забарвленості його сполук.
Загальний опис[ред. | ред. код]
Хром — це сталево-сірий, блискучий, твердий та крихкий метал[2], що має високу температуру плавлення. Назва елемента походить від грецького слова «chrōma» (χρώμα), що означає кольоровий[3], оскільки багато його сполук інтенсивно забарвлені.
Оксид хрому використовували китайці в династії Цінь ще 2000 років тому для покриття металевої зброї. Хром був виявлений як елемент після того, як у поле зору західного світу потрапив червоний кристалічний мінерал крокоїт (хромат свинцю (II) хромату), виявлений у 1761 році. Спочатку використовувався як пігмент. Луї Ніколя Воклен першим виділив металевий хром з мінералу в 1797 році.
Металічний хром та сплав ферохрому добувається з хромітів силікотермічною чи алюмінотермічною реакцію. Хром має високий корозійний опір і твердість. Його додають при виробництві нержавіючої сталі. Цей процес, разом з хромуванням, складають 85 % комерційного використання елемента.
Тривалентний іон хрому, можливо, знаходиться у слідових кількостях в ліпідіах, хоча це питання залишається в дебатах[4]. У великих кількостях сполуки металу можуть бути токсичними та канцерогенними. Найвідомішим прикладом токсичної сполуки є шестивалентний хром (Cr(VI)).
Поширеність[ред. | ред. код]


Хром — 24-й елемент за поширеністю у земній корі із середньою концентрацію 100 частин на мільйон.[5] Сполуки хрому перебувають в навколишньому середовищі внаслідок ерозії хромсовмісних порід або вивержень вулканів. Діапазон концентрацій у ґрунті становить від 1 до 300 мг/кг, у морській воді від 5 до 800 мкг/л, у річках та озерах 26 мкг/літр до 5,2 мг/л.[6]
Метал видобувають з хроміту (FeCr2O4).[7] Близько двох п'ятих хромітових руд і концентратів у світі виробляються в Південній Африці. Видобуванням хромітів також займається Казахстан, Індія, Росія і Туреччина. Нерозвинені родовища хромітів зосереджені в Казахстані та Південній Африці.[8]
Хоч і рідко, існують поклади самородного хрому[9][10]. У Росії виробляються зразки самородного металу. У шахті «Удачній», багатій на кімберліт та діаманти у відновному середовищі добувається елементарний хром і алмаз.[11]
Фізичні властивості[ред. | ред. код]
У вільному вигляді хром — сірий метал з кубічною об'ємно-центрованою ґраткою, а = 0,28845 нм. Це єдина елементарна тверда сполука, яка виявляє антиферомагнітні властивості при кімнатній температурі (і нижче). При температурі вище 38 °C він перетворюється на парамагнетик.
Хром має твердість за шкалою Мооса 5[12], найтвердіший із чистих металів. Дуже чистий хром достатньо добре піддається механічній обробці.
Металічний хром на повітрі пасивує під дією кисню, утворюючи тонкий захисний шар поверхневого оксиду. Шар, що складається лише з кількох атомів завтовшки, є дуже щільним і, на відміну від заліза або нелегованої сталі, запобігає дифузії кисню в матеріал та виникненню іржі[13]. Пасивація може бути підвищена шляхом короткочасного контакту з такою кислотою-окисником як азотна. Протилежний ефект досягається при обробці сильним відновником, який руйнує захисний оксидний шар на металі. Хром, оброблений таким способом, легко розчиняється в навіть в слабких кислотах.
Ізотопи[ред. | ред. код]
Природний хром складається з трьох стабільних ізотопів: 52Cr, 53Cr і 54Cr; 52 Cr є найпоширенішим (83,789 %). Із 19 досліджених радіоізотопів найстабільнішим є 50Cr з періодом напіврозпаду більше 1,8 × 1017 років, а для 51Cr період напіврозпаду становить 27,7 днів. Усі інші радіоактивні ізотопи мають періоди напіврозпаду менше 24 годин, більшість з них мають — менше 1 хвилини. Цей елемент також має 2 метастани.[14]
Всього відомо 25 ізотопів хрому з 42Cr по 67Cr.
Хімічні властивості[ред. | ред. код]
Хром є елементом перехідних металів, перший елемент шостої групи. Хром (0) має електронну конфігурацію 4s13d5. Метал володіє широким спектром можливих окиснення, де +3 є найбільш енергетично стабільним, тому сполуки Хрому +3 і +6 характерніші, у той час як +1, +4 і +5 — рідкісні.
| Ступені окиснення | |
|---|---|
| 0 | Cr(C6H6)2 |
| +1 | K3[Cr(CN)5NO] |
| +2 | CrCl2 |
| +3 | CrCl3 |
| +4 | K2CrF6 |
| +5 | K3CrO8 |
| +6 | K2CrO4 |
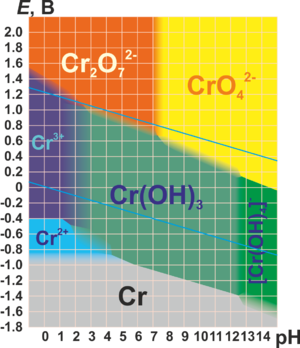
Нижче наведена Діаграма Пурбе для хрому в чистій воді, соляній кислоті або гідроксиді натрію:
Проста речовина[ред. | ред. код]

Стійкий на повітрі за рахунок пасивації, не реагує з нітратною кислотою. З хлоридною кислотою в інертному середовищі взаємодіє, окиснюючись до двохвалентного хлориду. Реакція з концентрованою сульфатною кислотою протікає наступним чином:
При 2000 ° C згоряє з утворенням зеленого оксиду хрому(III) Cr2O3, що володіє амфотерними властивостями. Синтезовано сполуки хрому з бором (бориди Cr2B, CrB, Cr3B4, CrB2, CrB4 та Cr5B3), з вуглецем (карбіди Cr23C6, Cr7C3 та Cr3C2), з кремнієм (силіциди Cr3Si, Cr5Si3 і CrSi) і азотом (нітриди CrN і Cr2N).
Сполуки Хрому (+2)[ред. | ред. код]
Ступені окиснення +2 відповідає основний оксид CrO чорного кольору. Солі Cr2+ (розчини блакитного кольору) утворюються при відновленні солей Cr3+ або дихроматів цинком в кислому середовищі (воднем в момент виділення):
Солі Cr2+ — сильні відновники, при стоянні витісняють водень із води[15]. Киснем повітря, особливо в кислому середовищі, Cr2+ окиснюється, внаслідок чого блакитний розчин швидко зеленіє:
Коричневий або жовтий гідроксид Cr(OH)2 осідає при додаванні лугів до розчинів солей хрому(II).
Синтезовано дигалогеніди CrF2, CrCl2, CrBr2 та CrI2.
Сполуки Хрому (+3)[ред. | ред. код]

Ступені окиснення +3 відповідає амфотерний оксид Cr2O3 та гідроксид Cr(OH)3 (обидва зеленого кольору). Це найстійкіша ступінь окиснення для хрому. Його сполуки мають колір від брудно-лілового (іон [Cr(H2O) 6]3+) до зеленого (в координаційній сфері присутні аніони).
Cr3+ схильний до утворення подвійних сульфатів виду MICr(SO4) 2·12H2O (галунів)
Гідроксид хрому(III) отримують, діючи амоніаком на розчини солей хрому(III) :
Можна використовувати розчини лугів, але при їх надлишку утворюється розчинний гідроксокомплекс:
Сплавлені Cr2O3 з лугами отримують хроміти:
Непрожарений оксид хрому(III) розчиняється в лужних розчинах і в кислотах:
При окисненні сполук хрому(III) в лужному середовищі утворюються сполуки хрому(VI) :
Те ж саме відбувається при сплавленні оксиду хрому(III) з лугом та окислювачами, або з лугом на повітрі (розплав при цьому набуває жовтого забарвлення):
Сполуки Хрому (+4)[ред. | ред. код]
При обережному розкладанні оксиду хрому(VI) CrO3 в гідротермальних умовах отримують хром(IV) оксид CrO2, який є феромагнетиком і має металеву провідність.
Серед тетрагалогенідів хрому стійким є флуорид CrF4, а тетрахлорид хрому CrCl4 існує лише в парах.
Сполуки Хрому (+6)[ред. | ред. код]

Ступені окислення +6 відповідає кислотний оксид хрому(VI) CrO3 та цілий ряд кислот, між якими існує рівновага. Найпростіші з них — хроматна H2CrO4 та дихроматна H2Cr2O7. Вони утворюють два ряди солей: жовті хромати та помаранчеві дихромати відповідно.
Оксид хрому(VI) CrO3 утворюється при взаємодії концентрованої сірчаної кислоти з розчинами дихроматів. Типовий кислотний оксид, при взаємодії з водою він утворює сильні нестійкі хромові кислоти: хромову H2CrO4, дихромову H2Cr2O7 та інші ізополікислоти із загальною формулою H2CrnO3n+1. Збільшення ступеня полімеризації відбувається зі зменшенням рН, тобто збільшенням кислотності:
Але якщо до помаранчевого розчину K2Cr2O7 прилити розчин лугу, забарвлення знову переходить в жовте, оскільки знову утворюється хромат K2CrO4:
До високого ступеня полімеризації, як це відбувається у вольфраму та молібдену, не доходить, оскільки поліхромова кислота розпадається на оксид хрому(VI) і воду:
Розчинність хроматів приблизно відповідає розчинності сульфатів. Зокрема, жовтий хромат барію BaCrO4 випадає при додаванні солей барію як до розчинів хроматів, так і до розчинів дихроматів:
Відомі пентафлуорид хрому CrF5 та малостійкий гексафлуорид хрому CrF6. Також отримані леткі оксогалогеніди хрому CrO2F2 та CrO2Cl2.
Сполуки хрому(VI) — сильні окисники, наприклад:
Додавання до дихромату перекису водню, сірчаної кислоти та органічного розчинника (етеру) призводить до утворення синього пероксиду хрому CrO5L (L — молекула розчинника), який екстрагується в органічний шар; ця реакція використовується як аналітична.
Отримання[ред. | ред. код]

Хроміт заліза (хромистий залізняк) при 1200 °C перетворюють в хромат:
Хромат розчиняють у воді і сірчаною кислотою переводять у дихромат:
Дихромат натрію кристалізується при охолоджені як дигідрат. При наступному відновленні вуглецем отримують Хром(III) оксид:
У кінцеві стадії відновлюють хром алюмотермічно:
Застосування[ред. | ред. код]
На початку XIX ст. сполуки хрому використовувалися як вогнетривкий матеріал для футерування металургійних печей, отримання фарб і дублення шкіри. Наприкінці XIX ст. хром почали широко використовувати для легування сталі. Сьогодні основним споживачем хромітів є металургійна промисловість (65 %), значно менше — промисловість вогнетривів (18 %) і хімічна (17 %) промисловість. Хром — один з основних компонентів неіржавної жароміцної, кислототривкої сталі і важливого інгредієнта корозійностійких і жароміцних суперсплавів. Добавка ферохрому (65–70 % Cr, 5–7 % С, інше — Fe) або чарж-хрому (54 % Cr, 6–7 % С, інше Fe) до сталей підвищує їх в'язкість, твердість і антикорозійні властивості (нержавіючі, жароміцні, кислототривкі, інструментальні і інші види сталей). Сплави хрому з кобальтом, вольфрамом або молібденом використовуються як антикорозійні покриття (хромування). Штучний радіоактивний ізотоп 51Cr — ізотопний індикатор. Сполуки хрому застосовують як фарби, окисники, дубильні речовини, протрави при фарбуванні.
Хром та його аналоги широко використовують як легувальні додатки до спеціальних неіржавних сталей, які містять більше 10 % хрому. При меншому вмісті хрому сталь набуває значної міцності та твердості. Сплав нікелю з хромом ніхром (80 % Ni, 20 % Cr) має високу температуру плавлення, його використовують в нагрівальних елементах печей, які дають можливість досягти температури +1100 °C.
Біологічна роль[ред. | ред. код]

Хром відіграє важливу біологічну роль в організмі людини. Він позитивно впливає на процеси кровотворення, а також на ферментативні системи. У складі ферменту трипсину хром бере участь у процесі травлення. Вчені встановили, що вилучення хрому з харчового раціону тварин приводить до підвищення у крові та сечі глюкози. Додавання хрому до їжі хворим на діабет нормалізує вуглеводний обмін. Хром в організм людини потрапляє з такими харчовими продуктами, як соя, кукурудзяна та вівсяна крупи. Добова потреба організму в хромі становить 5–10 мг.
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ A Course In Thermodynamics, Volume 2 [Архівовано 1 березня 2019 у Wayback Machine.](англ.)
- ↑ Brandes, E. A.; Greenaway, H. T.; Stone, H. E. N. (1956). Ductility in Chromium. Nature. 178 (587): 587. Bibcode:1956Natur.178..587B. doi:10.1038/178587a0.
- ↑ χρώμα [Архівовано 13 липня 2019 у Wayback Machine.], Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- ↑ Cronin, Joseph R. (2004). The Chromium Controversy. Alternative and Complementary Therapies. 10 (1): 39—42. doi:10.1089/107628004772830393.
- ↑ Emsley, John (2001). Chromium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. с. 495–498. ISBN 0-19-850340-7.
- ↑ Kotaś, J.; Stasicka, Z (2000). Chromium occurrence in the environment and methods of its speciation. Environmental Pollution. 107 (3): 263—283. doi:10.1016/S0269-7491(99)00168-2. PMID 15092973.
- ↑ National Research Council (U.S.). Committee on Biologic Effects of Atmospheric Pollutants (1974). Chromium. National Academy of Sciences. с. 155. ISBN 978-0-309-02217-0.
- ↑ Papp, John F. Commodity Summary 2009: Chromium (PDF). United States Geological Survey. Архів оригіналу (PDF) за 13 серпня 2012. Процитовано 17 березня 2009.
- ↑ Fleischer, Michael (1982). New Mineral Names (PDF). American Mineralogist. 67: 854—860. Архів оригіналу (PDF) за 26 вересня 2021. Процитовано 26 вересня 2013.
- ↑ Chromium [Архівовано 17 вересня 2021 у Wayback Machine.] (with location data), Mindat
- ↑ Chromium from Udachnaya-Vostochnaya pipe, Daldyn, Daldyn-Alakit kimberlite field, Saha Republic (Sakha Republic; Yakutia), Eastern-Siberian Region, Russia [Архівовано 26 вересня 2021 у Wayback Machine.], Mindat
- ↑ Поварьонних А. С. Твердість мінералів. — К. : АН УРСР, 1963. — С. 197-208.
- ↑ Wallwork, G. R. (1976). The oxidation of alloys. Reports on the Progress Physics. 39 (5): 401—485. Bibcode:1976RPPh...39..401W. doi:10.1088/0034-4885/39/5/001.
- ↑ Georges, Audi; Bersillon, O.; Blachot, J.; Wapstra, A.H. (2003). The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A. Atomic Mass Data Center. 729: 3—128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ Некрасов Б. В. Курс общей химии. — М.: ГНХТИ, 1952. — С. 334
Література[ред. | ред. код]
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2013. — Т. 3 : С — Я. — 644 с.
- Хром в організмі людини і тварин. Біохімічні, імунологічні та екологічні аспекти / Л. І. Сологуб, Г. Л. Антоняк, Н. О. Бабич. — Львів : Євросвіт, 2007. — 127 с. : іл., табл. ; 20 см. — Бібліогр.: с. 79—126 (404 назви). — 350 пр. — ISBN 978-966-8364-13-6
- U.S. Geological Survey, 2020, Mineral commodity summaries 2020: U.S. Geological Survey, 200 p. [Архівовано 7 серпня 2020 у Wayback Machine.], https://doi.org/10.3133/mcs2020.
Посилання[ред. | ред. код]
- ХРОМ [Архівовано 3 серпня 2016 у Wayback Machine.] //Фармацевтична енциклопедія



![{\displaystyle \mathrm {2Cr^{3+}{\xrightarrow[{Zn,HCl}]{[H]}}2Cr^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e3aef7546ffcc1490cf3d723d8762f50abc43ef)




![{\displaystyle \mathrm {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/07a95033761d3cfef2870dc9afbd450963f6b59f)


![{\displaystyle \mathrm {2Na_{3}[Cr(OH)_{6}]+3H_{2}O_{2}\rightarrow 2Na_{2}CrO_{4}+2NaOH+8H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/adc8d2208f4819d615cfc1968d0315d446139013)















