Tel·luri
| Tel·luri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
52Te
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris platejat brillant  Línies espectrals del tel·luri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Tel·luri, Te, 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metal·loides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 16, 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 127,60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d10 5s2 5p4 2, 8, 18, 18, 6 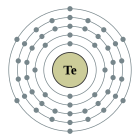
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
6,24 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
5,70 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 722,66 K, 449,51 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 1.261 K, 988 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 17,49 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 114,1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,73 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 5, 4, 2, -2 (àcid òxid bàsic) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,1 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 869,3 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.790 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.698 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 138±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 206 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal[1] 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | (1,97–3,38) W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 2.610 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 65 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 2,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 180 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 13494-80-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del tel·luri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El tel·luri o tel·lur[3] és un element químic el símbol del qual és Te el seu nombre atòmic és 52. S'ubica en el 5è període de la taula periòdica i en el grup 16 dels calcògens. Fou descobert el 1783 pel químic Franz-Joseph Müller von Reichenstein en la calaverita, un mineral d'or. És un element químic escàs a l'escorça terrestre, malgrat que és present en molts de minerals. És semiconductor i s'usa en aliatges, com a catalitzador, en la fabricació de panells solars i els seus composts en la indústria electrònica.
Història[modifica]

El tel·luri fou descobert el 1783 per Franz-Joseph Müller von Reichenstein (1740-1825) a Sibiu, Romania, aleshores de l'Imperi Austrohongarès. Quedà intrigat pel mineral d'una mina d'or de Zlatna, Romania, de la seva col·lecció de minerals rars que havia anat recollint en els seus viatges. Aquest mineral, la calaverita, tenia una brillantor metàl·lica i que sospitava que era antimoni o sulfur de bismut (en realitat era ditel·lurur d'or ). La investigació que dugué a terme demostrà que no hi havia ni antimoni ni bismut. Durant tres anys, Müller investigà el mineral i arribà a la conclusió que contenia or i un element nou. Publicà les seves troballes en una revista obscura de Viena i el descobriment passà desapercebut per a la majoria de químics.[4]

El 1796, Müller envià una mostra al químic alemany Martin Heinrich Klaproth (1743-1817) a Berlín, que li confirmà el descobriment. Klaproth obtingué una mostra pura i decidí anomenar-ho tel·luri, derivat de la paraula llatina tellus, –ūris ‘Terra’. Curiosament, aquesta no era la primera mostra de tel·luri que li havia passat per les mans. El 1789, un científic hongarès, Pál Kitaibel (1757-1817), li havia enviat una mostra que havia aïllat i que demostrava que l'havia descobert de forma independent.[4]
Abundància i obtenció[modifica]

El tel·luri és un element escàs a la Terra, ocupa la posició 72a dels 90 elements naturals ordenats per abundància.[4] Malgrat això se'l pot trobar en molts minerals poc abundants. Els minerals que contenen més d'un 70 % de tel·luri són: tel·luri natiu 100 %, diliti 90,19 %, frohbergita 82,05 %, melonita 81,30 %, mattagamita 81,24 %, paratel·lurita 79,95 %, tel·lurita 79,95 % i walfordita 72,24 %.[5] La producció mundial el 2019 fou d'unes 470 tones, essent els principals productors de tel·luri: la Xina 290 t, Japó 55 t, Rússia 40 t i Suècia 40 t. S'ha calculat que hi existeixen unes reserves d'unes 31 000 t. Més del 90% del tel·luri s'obté a partir de llims d'ànodes recollits de la refinació electrolítica de coure, i la resta a partir dels residus de les refineries de plom i dels gasos de combustió generats durant la fosa de bismut, coure i minerals de plom-zinc.[6]
L'extracció del tel·luri és complexa, ja que el mètode emprat depèn de quins altres compostos o elements estiguin presents. El primer pas sol comportar una oxidació en presència de carbonat de sodi:[7]
El tel·lurit de sodi s'acidifica amb àcid sulfúric i el tel·luri precipita com a diòxid (deixant àcid tel·lurós, en la dissolució). El tel·luri s'allibera del diòxid mitjançant una dissolució en hidròxid de sodi i reducció electrolítica:[7]
Propietats[modifica]
Propietats físiques[modifica]

El tel·luri a temperatura ambient és un sòlid de densitat 6,23 g/cm³, punt de fusió 449,51 °C i punt d'ebullició 988 °C.[8] Té propietats a mig camí entre els metalls i els no-metalls. L'element cristal·litza en forma romboèdrica. És de color blanc platejat i isomorf amb el seleni gris, és a dir, que l'estructura i les dimensions dels cristalls són molt similars. És trencadís, però no gaire dur. Els àtoms de tel·luri formen cadenes espirals al cristall amb distàncies Te—Te de 3,74 Å. És mal conductor de la calor.[9] Presenta semiconductivitat del tipus p, i presenta conductivitat elèctrica en certes direccions en funció de l'ordenació dels àtoms. Aquesta conductivitat s'incrementa significativament quan se l'exposa a la llum.[8]
Propietats químiques[modifica]
La configuració electrònica del tel·luri és [Kr]4d105s25p4 i presenta els estats d'oxidació −2, +2, +4, +6.[8]
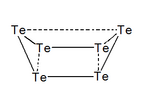
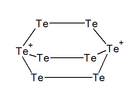
El tel·luri forma diferents cations essent el calcogen que en forma més. Així s'han observat els cations: , , , , i , i també les espècies polimèriques , , i .[10]
El tel·luri no reacciona amb l'aigua i amb l'aire reacciona amb l'oxigen per donar diòxid de tel·luri segons la reacció:[7]

En condicions controlades amb cura en un tub segellat, el tel·luri reacciona amb el clor per formar diclorur de tritel·luri . Reacciona també amb el fluor per formar l'hexafluorur de tel·luri de color taronja:[7]
Amb cura, el tel·luri reacciona amb el fluor barrejat amb gas nitrogen a 0 °C per formar el tetrafluorur de tel·luri. El tel·luri també reacciona en condicions controlades amb els altres halògens (clor, brom i iode) per formar els respectius tetrahalurs de tel·luri:[7]

El tel·luri mostra la capacitat de combinar-se amb els metalls per formar tel·lururs, espècies químiques amb propietats semblants als sulfurs i, sovint, amb aspecte metàl·lic. Quan els metalls alcalins —liti, sodi, potassi, rubidi i cesi— es combinen amb el tel·luri, tenen una alta solubilitat en aigua, produint ions i que es dissolen en el medi aquós.[11] Un bon nombre de minerals que són químicament tel·lurs. Com a exemples, hi ha l'altaïta, constituïda per tel·lurur de plom(II), ; que és una important mena metàl·lica del plom; la calaverita, ditel·lurur d'or, , que és mena d'or; la coloradoïta, que és tel·lurur de mercuri(II), ; l'hessita, tel·lurur d'argent(I), ; o la petzita, ditel·lurur de triargent i or, .[5] Tenen importància industrial el tel·lurur de cadmi , el tel·lurur de cadmi i manganès , el tel·lurur de cadmi i zinc i el tel·lurur de bismut .[12]
Isòtops[modifica]
Es coneixen 55 isòtops i isòmers nuclears del tel·luri amb números màssics des del 105 al 142. El tel·luri natural presenta vuit isòtops, dels quals quatre són radioactius amb períodes de semidesintegració superiors als deu bilions d'anys, per la qual cosa se'ls considera estables. El tel·luri 128 té el període de semidesintegració més llarg conegut entre tots els radioisòtops de tel·luri (2,2 × 1024 anys). El tel·luri és l'element amb menor nombre atòmic que pot experimentar la desintegració alfa, amb els isòtops del tel·luri 105 al tel·luri 110 pot experimentar aquest tipus de desintegració.[7] Un exemple és:
El tel·luri 120 s'utilitza per a la producció de iode 120 que té una aplicació com a isòtop emissor de positrons de tomografia per emissió de positrons o PET i radiació beta. El tel·luri 122 s'usa en la producció del radioisòtop iode 122 que es fa servir en gammagrafies. El tel·luri 123 s'empra per a la producció de iode 123 radioactiu que es fa servir en gammagrafies de tiroides. El tel·luri 124 es fa ús tant per a la producció de iode 123 com de l'isòtop iode 124 que s'empra en PET. Finalment, el tel·luri 130 es fa servir en la investigació sobre la doble desintegració beta.[7]
Aplicacions[modifica]
Indústria metal·lúrgica[modifica]
Aproximadament el 55 % de la demanda del mercat de tel·luri és per a la producció d'aliatges.[11] L'ús principal del tel·luri és la seva addició a l'acer per a millorar-ne les propietats mecàniques, com són la duresa i la resistència a la corrosió. També és fet servir com a additiu en els aliatges de coure perquè millora la maquinabilitat sense perdre conductivitat elèctrica. El tel·luri, afegit al plom, en millora la duresa i n'incrementa la resistència als àcids.[12]
Indústria química[modifica]

El tel·luri és un catalitzador usat en la producció de fibra sintètica. També s'utilitza en la producció de pneumàtics per a accelerar el procés de vulcanització del cautxú, procés pel qual s'escalfa el cautxú en presència de tel·luri, en substitució del sofre o del seleni, i se'l fa més dur i resistent.[12] En aquest camp s'empra el 25 % del tel·luri consumit.[11]
Generació d'energia[modifica]

El tel·luri s'empra cada vegada més en la fabricació de cèl·lules solars de cadmi i tel·luri. El tel·lurur de cadmi es fa servir com a finestra òptica d'infraroig i com a material de cèl·lula solar. En general s'intercala amb sulfur de cadmi per a formar una cèl·lula fotoelèctrica de junció PN. Normalment, les cèl·lules de tel·lurur de cadmi fan servir una estructura nip.[12]
Indústria electrònica[modifica]
Tel·lurur de cadmi i zinc s'utilitza en detectors de raigs gamma per a la medicina (en tomografia per emissió de positrons, PET) i la indústria; el tel·lurur de cadmi i manganès s'utilitza com a semiconductor sensible a la radiació infraroja. L'òxid de tel·luri s'usa en la preparació de la superfície regravable dels DVD i Blu-ray. El tel·lurur de bismut és un dels composts clau de les plaques Peltier, que produeixen fred o calor a conseqüència del pas d'un corrent elèctric a través de la junció de dos metalls, aliatges o semiconductors (efecte Peltier).[12]
Toxicitat[modifica]
El tel·luri no té un paper biològic conegut. És molt tòxic i teratogen, ja que pertorba el desenvolupament d'un embrió o fetus.[13] Les intoxicacions són rares i gairebé exclusivament els treballadors exposats laboralment es veuen afectats. Només hi ha constància d'alguns casos d'intoxicació no laboral. Una intoxicació greu provoca depressió respiratòria i col·lapse circulatori. Després de l'exposició laboral, els principals símptomes i signes inclouen pèrdua de gana, sequedat de la boca, supressió de la sudoració, gust metàl·lic a la boca i, el més notable, una forta olor d'all de l'alè, la suor i l'orina.[14]
Referències[modifica]
- ↑ Tellurium, mindat.org (anglès)
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press (en anglès)
- ↑ «tel·lur». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ 4,0 4,1 4,2 Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ 5,0 5,1 Barthelmy, David. «Mineral Species sorted by the element Te Tellurium». Mineralogy Database, 1997-2014. [Consulta: 10 març 2020].
- ↑ «Selenium and Tellurium Statistics and Information». Mineral Commodity Summaries. U.S. Geological Survey. [Consulta: 10 març 2020].
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 Winter, Mark. «Tellurium, the essentials». WebElements. The University of Sheffield and WebElements Ltd, UK, 1993-2023. [Consulta: 11 març 2020].
- ↑ 8,0 8,1 8,2 William M. Haynes. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 97. Boca Raton, Florida: CRC Press, 2016. ISBN 978-1-4987-5429-3.
- ↑ «Tellurium | chemical element» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 26-01-2020. [Consulta: 11 març 2020].
- ↑ Chivers, T. Inorganic rings and polymers of the p-block elements : from fundamentals to applications. Cambridge: RSC Pub, 2009. ISBN 978-1-84755-906-7.
- ↑ 11,0 11,1 11,2 Medina-Cruz, David; Tien-Street, William; Vernet-Crua, Ada; Zhang, Bohan; Huang, Xinjing. Tellurium, the Forgotten Element: A Review of the Properties, Processes, and Biomedical Applications of the Bulk and Nanoscale Metalloid (en anglès). Cham: Springer International Publishing, 2020, p. 723–783. DOI 10.1007/978-3-030-34471-9_26. ISBN 978-3-030-34470-2.
- ↑ 12,0 12,1 12,2 12,3 12,4 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ «Tellurium - Element information, properties and uses | Periodic Table». Royal Society of Chemistry. [Consulta: 7 març 2023].
- ↑ Müller, R.; Zschiesche, W.; Steffen, H. M.; Schaller, K. H. «Tellurium-intoxication» (en anglès). Klinische Wochenschrift, 67, 22, 1989-11, pàg. 1152–1155. DOI: 10.1007/BF01726117. ISSN: 0023-2173.
Vegeu també[modifica]
Enllaços externs[modifica]
- Los Alamos National Laboratory - Tel·luri (anglès)
- webelements.com - Tel·luri (anglès)
- environmentalchemistry.com - Tel·luri (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||