Silane (famille de composés)
En chimie, les silanes sont, selon la définition de l'IUPAC, la famille des composés chimiques constitués d'un squelette de silicium et d'hydrogène, de formule brute générale SinH2n+2[1]. Le terme est construit par calque avec celui d'« alcanes », leurs analogues carbonés, tout comme les germanes sont les analogues au germanium. Comme les alcanes, les silanes peuvent avoir une structure linéaire (n-silanes) ou ramifiée (iso- et néo-silanes). Selon la longueurs de la chaîne, ils peuvent être divisés en oligosilanes (chaîne courte) ou en polysilanes[1]. Ils existent également sous la forme de composés cycliques, les cyclosilanes, dont les composés monocycliques ont pour formule brute générale SinH2n.
Le terme silane est aussi utilisé de façon moins rigoureuse pour désigner les dérivés hydrocarbyle et autres dérivés des silanes vrais[1].
Structure et propriétés[modifier | modifier le code]
S'il existe des silanes ramifiés et cycliques, ils sont bien moins nombreux et diversisfiés que les alcanes. En 2020, on connaissait des silanes acycliques linéaires ou ramifiés ayant jusqu'à huit atomes de silicium, et des silanes cycliques ayant jusqu'à six atomes de silicium. Tous se présentent comme des gaz ou des liquides incolores aux conditions normales de température et de pression[2]. Les polysilanes deviennent rapidement instables à mesure qu'ils s'allongent, mais sont bien plus stables sous forme d'halogénures ou de dérivés substitués avec des résidus organiques[3].
Les silanes ont des propriétés semblables aux alcanes qui leur correspondent, comme le point de fusion, le point d'ébullition et le moment dipolaire[4]. Comme les alcanes, ils adoptent généralement une géométrie tétraédrique résultant de l'hybridation sp3 des orbitales liantes. Il existe cependant des différences fondamentales entre la chimie des hydrocarbures et celle des silanes[3]. Le silicium étant moins électronégatif que le carbone et l'hydrogène, les liaisons dans les silanes sont généralement plus polarisées que celles des composés hydrocarbonés analogues. Les atomes d'hydrogène liés ont un caractère électronégatif et réagissent donc facilement avec les atomes d'hydrogène des acides[4].
L'énergie de liaison Si–H est de 378 kJ/mol, sensiblement inférieure à celle de la liaison C–H, qui vaut plutôt 414 kJ/mol, ce qui rend les silanes thermiquement moins stables que les alcanes[4].
Silanes linéaires[modifier | modifier le code]
La série homologue des silanes linéaires répond à la formule SinH2n+2 avec n = 1, 2, 3, etc.
| Silane | Formule | Point de fusion[5] | Point d'ébullition[5] | Masse volumique[6] | Masse molaire |
|---|---|---|---|---|---|
| Silane | SiH4 | −184,7 °C | −112,1 °C | (gaz) 1,35 kg/m3 | 32,12 g/mol |
| Disilane | Si2H6 | −129,4 °C | −14,8 °C | (gaz) 2,87 kg/m3 | 62,22 g/mol |
| Trisilane | Si3H8 | −116,9 °C | 52,9 °C | 0,739 g/cm3 | 92,32 g/mol |
| Tétrasilane | Si4H10 | −91,6 °C | 108,4 °C | 0,795 g/cm3 | 122,42 g/mol |
| Pentasilane | Si5H12 | −72,2 °C | 153,2 °C | 0,827 g/cm3 | 152,52 g/mol |
| Hexasilane | Si6H14 | −44,7 °C | 193,6 °C | 0,847 g/cm3 | 182,62 g/mol |
| Heptasilane | Si7H16 | −30,1 °C | 226,8 °C | 0,859 g/cm3 | 212,73 g/mol |
| Octasilane | Si8H18 | — | — | — | 242,83 g/mol |
Seul le silane SiH4 se conserve indéfiniment à température ambiante : c'est le plus stable des silanes[2]. En l'absence de catalyseur, il ne se décompose qu'à 500 °C[4]. Les termes supérieurs de la série des silanes linéaires sont de moins en moins stables thermiquement et se décomposent même à température ambiante à la lumière du jour, en donnant des polymères, des silanes plus légers et de l'hydrogène[2],[7]. Le chauffage à des températures plus élevées conduit à la décomposition des silanes en silicium et hydrogène. Il se forme ainsi du silane SiH4 pendant la thermolyse des silanes supérieurs et des silanes substitués tels que le trichlorosilane HSiCl3 et le triéthoxysilane HSi(OCH2CH3)3[3] :
- 4 HSiCl3 ⟶ 3 SiCl4 + SiH4 ;
- 4 HSi(OCH2CH3)3 ⟶ 3 Si(OCH2CH3)4 + SiH4.
Silanes ramifiés et cycliques[modifier | modifier le code]
À partir du tétrasilane Si4H10, il existe des isomères de chaîne tels que l'isotétrasilane[8] HSi(SiH3)3, analogue de l'isobutane HC(CH3)3, l'isopentasilane SiH3SiH2SiH(SiH3)2 et le néopentasilane[9] Si(SiH3)4, analogues respectivement de l'isopentane CH3CH2CH(CH3)2 et du néopentane C(CH3)4. Il existe également des silanes cycliques. Ces différents isomères diffèrent les uns des autres par diverses propriétés telles que les points de fusion et d'ébullition.
| Silane | Formule | Structure | Point de fusion | Point d'ébullition | Masse volumique | Masse molaire | |
|---|---|---|---|---|---|---|---|
| Silanes ramifiés | |||||||
| Isotétrasilane | Si4H10 | 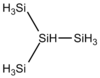
|
−99,4 °C | +101,7 °C | 0,793 g/cm3 | 122,42 g/mol | |
| Isopentasilane | Si5H12 | −109,8 °C | +146,2 °C | 0,820 g/cm3 | 152,52 g/mol | ||
| Néopentasilane | Si5H12 | −57,8 °C | +130 °C | — | 152,52 g/mol | ||
| Silanes cycliques | |||||||
| Cyclopentasilane | Si5H10 | 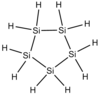
|
−10,5 °C | +194,3 °C | 0,963 g/cm3 | 150,51 g/mol | |
| Cyclohexasilane | Si6H12 | 
|
+16,5 °C | +226 °C | — | 180,61 g/mol | |
Réactions[modifier | modifier le code]
Les silanes sont moins stables que les alcanes analogues. Ils ne peuvent être produits qu'à l'abri de l'air. Les quatre silanes les plus légers sont très réactifs et pyrophoriques, c'est-à-dire qu'ils peuvent s'enflammer dans l'air, et y exploser. Leur combustion dans l'oxygène donne du dioxyde de silicium SiO2 et de l'eau H2O :
La réactivité des silanes décroît pour les composés les plus lourds, au-delà du tétrasilane. Ils sont en revanche relativement stables dans l'eau dépourvue d'oxygène et peuvent être stockés plus longtemps dans des solutions salines. Dans une eau basique, ils se décomposent lentement pour former de la silice et de l'hydrogène, réaction qui devient massive et immédiate dans les solutions fortement basiques. La réaction peut être contrôlée pour libérer une molécule d'hydrogène par liaison Si–H et Si–H, ce qui permet de
L'hydrolyse des organosilanes est une réaction de premier ordre. La vitesse d'hydrolyse de la liaison Si–H dépend du type et du nombre de résidus organiques. L'hydrolyse des trialkylsilanes est sensiblement plus lente que celle des triarylsilanes. Cela peut s'expliquer par un accroissement de la densité électronique sur l'atome de silicium sous l'effet des résidus alkyle. La vitesse de réaction des tri-n-alkylsilanes décroît ainsi dans l'ordre éthyle > propyle > butyle. Parmi les trialkylsilanes, ceux qui sont substitués avec des groupes n-alkyle réagissent dix fois plus vite que ceux qui ont des groupes alkyle ramifiés isomères[10].
Le silane SiH4 réagit avec le méthanol CH3OH pour donner le diméthoxysilane SiH2(OCH3)2, le triméthoxysilane SiH(OCH3)3 et le tétraméthoxysilane Si(OCH3)4 (orthosilicate de tétraméthyle), mais pas le méthoxysilane SiH3OCH3[4].
La réaction de silanes avec des métaux alcalins dissous dans des solvants donne les dérivés silyliques alcalins correspondants. Selon le solvant, deux réactions concurrentes peuvent avoir lieu, par exemple la première réaction seule dans l'hexaméthylphosphoramide [(CH3)2N]3PO (HMPA) et les deux simultanément dans le diméthoxyéthane CH3OCH2CH2OCH3[4] :
Avec les réactifs de Grignard, les silanes donnent les alkylsilanes correspondants, en formant préférentiellement les silanes peralkylés[4].
Les silanes peuvent également réagir avec l'azote aux alentours de 500 °C en se décomposant, ce qui donne du silicium qui réagit avec l'azote. Il est également possible d'utiliser un rayonnement micro-ondes pour favoriser la décomposition. Cette réaction est mise à profit par exemple pour déposer des couches minces de nitrure de silicium[11], ou pour produire des microcristaux de ce matériau[12].
Dérivés de silanes[modifier | modifier le code]
Dérivés halogénés[modifier | modifier le code]
Le chlorosilane SiH3Cl, le dichlorosilane SiH2Cl2, le trichlorosilane SiHCl3 et le tétrachlorure de silicium SiCl4 sont des dérivés halogénés bien connus du silane SiH4. Les trichlorosilane est particulièrement important dans l'industrie car il est facile à obtenir et est utilisé comme point de départ pour la production du silane, du dichlorosilane et du silicium ultrapur. Outre la préparation à partir de silicium et d'halogénure d'hydrogène par la méthode historique de Friedrich Wöhler, ils peuvent également être obtenus par réaction de silanes avec un halogénure d'hydrogène anhydre en présence de chlorure d'aluminium AlCl3 à température modérée[4] :
Bien que la réaction du silane avec le chlore et le brome soit explosive à température ambiante, elle peut être réalisée de manière contrôlée à des températures plus basses[4] :
Organosilanes[modifier | modifier le code]
La liaison Si–C est très stable et, dès 1917, Alfred Stock signalait l'existence de plus de 50 tétraalkylsilanes et tétraarylsilanes. Ces composés sont stables thermiquement, ils résistent à l'eau, et ils peuvent être halogénés, nitrés ou sulfonés sur le résidu organique sans que la liaison Si–C soit rompue[3]. Le tétraméthylsilane Si(CH3)4 est un composé important, en grande partie inerte chimiquement, qui est utilisé comme étalon en Spectroscopie RMN. En raison de la stabilité de la liaison Si–C, il est possible d'obtenir des composés tels que l'hexaphényldisilane Si2(C6H5)6 qui n'ont pas d'homologue carboné (l'hexaphényléthane (en) C2(C6H5)6 n'a jamais pu être synthétisé)[3].
Les organosilanes peuvent être préparés en faisant réagir des dérivés halogénés de silanes ou des silanes avec des organolithiens ou via une réaction de Grignard :
Les organohalosilanes sont produits à l'échelle industrielle au moyen de la synthèse de Müller-Rochow[4] :
- 2 CH3Cl + Si ⟶ SiCl2(CH3)2.
Silanols, siloxanes, silicones[modifier | modifier le code]
L'hydrolyse des silanes, et notamment de leurs dérivés halogénés, donne facilement des silanols qui, contrairement aux alcools analogues, sont relativement instables. Ils polymérisent avec élimination d'eau pour doner des siloxanes et des silicones, le chlorure d'hydrogène accélérant la polymérisation[13]. Les monosilanols forment des dimères, les silanediols des polymères linéaires et les silanetriols des réseaux tridimentionnels. Ces réactions sont favorisées par le fait que les liaisons Si–O–Si sont particulièrement stables.
Applications[modifier | modifier le code]
Le trichlorosilane SiHCl3 est un produit intermédiaire pour la production de silicium ultrapur destiné à l'industrie des semiconducteurs, à la réalisation de promoteurs d'adhérence et aux traitements de surface. La thermolyse de silanes sous atmosphère d'hydrogène permet également de déposer du silicium ultrapur (procédé Siemens (de)).
La silice pyrogénée, qui est notamment charge couramment utilisée avec les matières plastiques, peut être produite à partir de chlorosilanes et de chloroalkylsilanes par réaction dans une flamme d'oxyhydrogène. Des organosilanes fonctionnels sont utilisés pour la fonctionnalisation de surfaces, méthode appelée silanisation. Les chlorométhylsilanes, notamment le diméthyldichlorosilane SiCl2(CH3)2, sont utilisés comme matière première pour la production de silicones.
Il est possible de déposer une couche mince de silicium en oxydant le dichlorosilane SiH2Cl2 sous pression réduite[4]. Dans le cadre de la fabrication de dispositifs à semiconducteurs, un procédé de dépôt chimique en phase vapeur assisté par plasma (PECVD) permet, dans certaines conditions, de déposer des couches diélectriques en dioxyde de silicium SiO2 à partir de silane SiH4 et par exemple de monoxyde d'azote[14].
Les silanes les plus lourds, qui ne sont plus pyrophoriques, ont été étudiés comme ergols en astronautique. Ils présentent cependant un coût élevé et une impulsion spécifique plus faible que l'hydrazine ou les propergols LOX / LH2, mais des composés comme le pentasilane Si5H12 pourraient être utilisés comme additifs non toxiques pour certains propergols[6].
Notes et références[modifier | modifier le code]
- (en) « silanes », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, Elsevier, 2012, p. 337. (ISBN 978-0-08-050109-3)
- (en) Alfred Stock, « Zur Nomenklatur der Silicium‐verbindungen », Berichte der deutschen chemischen Gesellschaft, vol. 50, no 1, , p. 169-170 (DOI 10.1002/cber.19170500127, lire en ligne)
- (en) [PDF] Barry Arkles, « Silanes », p. 39, réimpression de Kirk-Othmer, Encyclopedia of Chemical Technology, 4e édition, vol. 22, John Wiley & Sons, 1997, p. 38-69. (ISBN 0-471-52691-6)
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., Walter de Gruyter, 1995, p. 485. (ISBN 3-11-012641-9)
- (de) Bernhard Hidding, « Untersuchung der Eignung von Silanenals Treibstoffe in der Luft- und Raumfahrt », sur web.archive.org, Université de la Bundeswehr à Munich et Université Heinrich Heine de Düsseldorf, (consulté le ).
- (de) Alfred Stock, Paul Stiebeler et Friedrich Zeidler, « Siliciumwasserstoffe, XVI.: Die höheren Siliciumhydride », Berichte der deutschen chemischen Gesellschaft (A and B Series), vol. 56, no 7, , p. 1695-1705 (DOI 10.1002/cber.19230560735, lire en ligne)
- (en) Barry Arkles, Youlin Pan, Fernando Jove, Jonathan Goff et Alain Kaloyeros, « Synthesis and Exploratory Deposition Studies of Isotetrasilane and Reactive Intermediates for Epitaxial Silicon », Inorganic Chemistry, vol. 58, no 5, , p. 3050-3057 (PMID 30785274, DOI 10.1021/acs.inorgchem.8b02761, lire en ligne)
- (en) James C. Sturm et Keith H. Chung, « Chemical Vapor Deposition Epitaxy of Silicon-based Materials using Neopentasilane », ECS Transactions, vol. 16, no 10, , p. 799 (DOI 10.1149/1.2986839, Bibcode 2008ECSTr..16j.799S, lire en ligne)
- (de) G. Schott et C. Harzdorf, « Silane. I Alkalische Solvolyse von Triorganosilanen », Zeitschrift für anorganische une allgemeine Chemie, vol. 306, nos 3-4, , p. 180-190 (DOI 10.1002/zaac.19603060306, lire en ligne)
- (en) Jingwei Song, Xiying Ma, Wang Zui, Chen Wei et Zhongpin Chen, « Fabrication of Si3N4 Nanocrystals and Nanowires Using PECVD », Advances in Materials Sciences and Engineering, vol. 2010, , article no 892792 (DOI 10.1155/2010/892792, lire en ligne)
- (en) J. R. Flemish et R. L. Pfeffer, « Low hydrogen content silicon nitride films from electron cyclotron resonance plasmas », Journal of Applied Physics, vol. 74, no 5, , p. 3277-3281 (DOI 10.1063/1.355318, Bibcode 1993JAP....74.3277F, lire en ligne)
- (de) Josef Goubeau et Rudolf Warncke, « Zur Hydrolyse von Halogeniden. I. Die Hydrolyse des Siliciumtetrachlorids », Zeitschrift für anorganische Chemie, vol. 259, nos 1-4, , p. 109-120 (DOI 10.1002/zaac.19492590109, lire en ligne)
- (de) Eugen Unger, « Die Erzeugung dünner Schichten. Das PECVD‐Verfahren: Gasphasenabscheidung in einem Plasma », Chemie in unzerer Zeit, vol. 25, no 3, , p. 148-158 (DOI 10.1002/ciuz.19910250306, lire en ligne)
Liens externes[modifier | modifier le code]
- Ressource relative à la santé :
