Réaction d'élimination
En chimie organique, une élimination (ou β-élimination) est une réaction organique qui transforme un alcane substitué (halogénoalcanes, alcools…) en dérivé éthylénique, voire en alcène, si la molécule de départ, outre le groupe partant, n'est qu'une chaîne carbonée de type alcane.
Les conditions sont, en plus dures, celles d'une substitution nucléophile, réaction proche par de nombreux aspects et concurrente : l'élimination se produit en présence d'une base forte et en chauffant le mélange réactionnel.
Équation générale[modifier | modifier le code]
L'un des principaux exemples d'élimination est la transformation d'un halogénoalcane en alcène ; on parle alors de déshydrohalogénation :
Les bases les plus couramment utilisées sont l'hydroxyde de sodium (Na+,HO−), l'hydroxyde de potassium (K+,HO−), voire les ions alcoolate (RO−) (obtenus en faisant réagir du sodium dans un alcool ROH, anhydre).
Tout comme pour la substitution nucléophile, il existe une élimination monomoléculaire et une élimination bimoléculaire que l'on note couramment « E1 » et « E2 » respectivement.
Dans la suite de cet article, les exemples sont donnés avec un dérivé halogéné en tant que réactif.
Élimination monomoléculaire[modifier | modifier le code]
Cinétique de l'E1[modifier | modifier le code]
La réaction d'élimination monomoléculaire se fait en deux étapes : une étape monomoléculaire qui ne fait intervenir que la molécule du dérivé halogéné du côté des réactifs, qui est l'étape cinétiquement déterminante (ou limitante), suivie d'une étape bimoléculaire. Par conséquent, la cinétique de la réaction, dans l'approximation de l'étape cinétiquement déterminante, ne dépend que de la concentration de l'espèce RX.
La réaction est caractérisée par une cinétique d'ordre global 1, d'ordres partiels 1 par rapport au dérivé halogéné et 0 par rapport à la base B| : v = k·[RX], où :
- [RX] représente la concentration en dérivé halogéné en mol/L ;
- v représente la vitesse de la réaction de l'élimination. Elle s'exprime en mol/s ;
- k est la constante de vitesse : c'est en fait celle de l'étape cinétiquement limitante (k1). Son unité, L/s, se déduit de celles des deux autres termes.
Mécanisme de l'E1[modifier | modifier le code]
La réaction se fait en deux étapes :
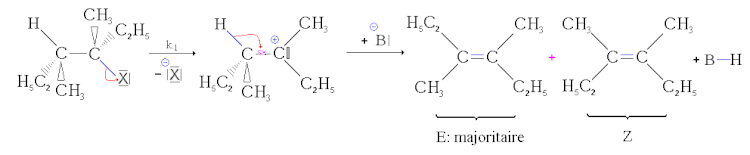
- première étape : départ du nucléofuge, formation d'un carbocation. cette étape de formation du carbocation est une étape lente, réversible et impose sa vitesse à l'ensemble de la réaction ;
- deuxième étape : réaction acide-base. La base arrache le proton. Le doublet se « rabat » alors sur la liaison carbone-carbone pour former une liaison double. Comme la liaison simple carbone-carbone peut pivoter, il peut se former deux stéréoisomères. Cette réaction étant beaucoup plus rapide que la précédente, sa vitesse n'influence pas la vitesse globale.

Stéréosélectivité et régiosélectivité[modifier | modifier le code]
Stéréochimie[modifier | modifier le code]
Comme le montre le mécanisme, le passage par un carbocation, qui est une structure plane, enlève tout élément de stéréospécificité contrairement (voir la suite) au mécanisme d'élimination bimoléculaire.
Mais, si deux stéréoisomères géométriques peuvent se former, ils ne se forment pas dans les mêmes proportions. L'isomère le plus stable, c'est-à-dire celui dont l'énergie est la plus basse, est formé majoritairement (c'est la règle de Zaïtsev). C'est donc l'isomère E qui est majoritairement formé en l'absence de mésomerie. Par contre si la double liaison de l'un des deux produits seulement est délocalisable par mésomerie alors c'est celui-ci qui sera formé majoritairement. On parle alors de stéréosélectivité partielle.
Régiochimie[modifier | modifier le code]
Lorsque plusieurs isomères de constitution peuvent se former, il se forme préférentiellement l'alcène thermodynamiquement le plus stable. S'il n'y a que des groupes alkyle, c'est l'alcène le plus substitué. Si des mésoméries peuvent intervenir, c'est l'alcène le plus conjugué qui est majoritaire. On parle alors de la régiosélectivité ou de la règle de Zaïtsev.
Cependant, parfois l'alcène thermodynamiquement le moins stable se forme préférentiellement, on parle alors de l'élimination de Hofmann. C'est le cas notamment lorsque la base utilisée est encombrée (ex. : KtBuO) ou lorsque l'on a un ion ammonium qui s'élimine par exemple. (Molécule portant une amine en présence de MeI en nombre d'équivalents suffisant pour former le sel d'ammonium, puis mise en présence d'oxyde d'argent humide et chauffé. Formation de l'alcène par élimination de Hofmann et départ de N(Me)3.)
Facteurs influant sur la réaction[modifier | modifier le code]
Les paramètres influençant l'élimination E1 sont :
- l'effet de R- : l'étape cinétiquement déterminante est la formation du carbocation (et non sa réactivité), donc plus celui-ci est stable, plus la réaction est favorisée ;
- le nucléofuge : la coupure de la liaison C-groupe partant étant l'étape clef du mécanisme, la réaction dépend fortement de la nature de ce nucléofuge. Meilleur est le groupe partant, plus la réaction est rapide. Par exemple pour la déshydratation des alcools, la première étape est la protonation de l'alcool pour former un oxonium, et donc un meilleur groupe partant (H2O ⇒ HO−). Un classement rapide des groupes partants serait :
- (Le symbole « > » signifie : meilleur groupe partant que.)
À noter que la base n'influence pas ce type de réaction d'ordre 1 et ceci dans la mesure où elle n'intervient pas lors de la première étape qui détermine la vitesse globale de la réaction.
Groupe alkyle du dérivé halogéné[modifier | modifier le code]
Le mécanisme passe par un intermédiaire réactionnel de type carbocation. Celui-ci est d'autant plus stable qu'il est substitué. Ainsi, la vitesse de réaction (donc de formation du carbocation) progresse des dérivés primaires, aux secondaires puis aux tertiaires. En pratique, seuls ces derniers, et quelques dérivés secondaires, réagissent par ce mécanisme.
Nucléofuge[modifier | modifier le code]
Plus la liaison R-X est polarisable, plus la rupture est facile. Cette liaison est donc de labilité (« fragilité ») décroissante du fluor à l'iode : F > Cl > Br > I.
- (Le symbole « > » signifie : plus rapidement que.)
Solvant[modifier | modifier le code]
- Polarité : un solvant polaire stabilise le carbocation ; il rend la première réaction plus facile. La vitesse croit avec la polarité du solvant.
- Proticité : un solvant protique est plutôt un handicap : en effet il risque d'entrer en concurrence avec le carbocation lors de la réaction acide-base(forte).
Concurrence[modifier | modifier le code]
Cette réaction est non seulement en concurrence avec l'autre élimination, mais aussi avec les réactions de substitutions nucléophiles, en particulier avec la SN1. Cette dernière se produit en effet dans des conditions similaires (outre le chauffage).
Élimination bimoléculaire[modifier | modifier le code]
Cinétique de l'E2[modifier | modifier le code]
La réaction d'élimination bimoléculaire a une cinétique d'ordre global 2 et d'ordre partiel 1 par rapport au dérivé halogéné R-X et à la base B:−. La réaction se fait en une seule étape qui est bimoléculaire. La vitesse de la réaction suit une loi de type : v=k·[R-X]·[B:−]
où :
- [R-X] représente la concentration en dérivé halogéné (exprimée en mol/L) ;
- [B:−] représente la concentration en base (exprimée en mol/L) ;
- v représente la vitesse de la réaction d'élimination. Elle s'exprime en mol/s ;
- k est la constante de vitesse. Son unité, L2·mol−1·s−1, se déduit de celles des trois autres termes.
Mécanisme de l'E2[modifier | modifier le code]
L'élimination bimoléculaire est une réaction en une étape, bimoléculaire.
Durant une même étape élémentaire se produisent l'arrachage du proton par la base, la formation de la liaison double, et le départ de l'atome d'halogène (nucléofuge) sous forme d'ion halogénure. On parle de mécanisme synchrone ou concerté.
Stéréochimie[modifier | modifier le code]
L'E2 est une réaction stéréospécifique si le carbone bêta possède un seul hydrogène. Elle peut dans le cas contraire être non stéréospécifique. Tout dépend du substrat.
La réaction ne se fait que lorsqu'un hydrogène et le groupe partant sont en position antipériplanaire.
Facteurs influant sur la réaction[modifier | modifier le code]
- La vitesse de réaction d'une E2 ne varie que faiblement selon la classe (primaire : I, secondaire : II, tertiaire : III) de l'halogénure considéré. Néanmoins, plus la classe est élevée et plus la réaction est rapide (III > II > I) pour une raison d'ordre stérique (l'élimination permet d'éloigner, dans le produit final, les substituants volumineux, donc « encombrants », présents dans le produit initial, le réactif, puisque l'on passe d'un angle valenciel de 109°28' dans celui-ci, au niveau du carbone hybridé sp3, porteur du proton H, à un angle valenciel de 120°, dans le produit final où ce même carbone est désormais hybridé sp2). On privilégie généralement un halogénoalcane primaire dans ce cas, mais lorsqu'on est en présence d'un halogénoalcane secondaire, on différencie les réactions de type E1 et E2 par les effets mésomères potentiels (effet « mésomère » : terme général définissant un effet électronique correspondant à une délocalisation de la charge, ici positive, sur un groupe aryle, par exemple, voisin immédiat, donc « en α », de la liaison C-H rompue, on parle de « déprotonation », par la base forte). Tout substituant de la chaîne carbonée susceptible de stabiliser l'ion carbénium (carbocation C+) intermédiaire par ce type d'effet électronique favorisera le mécanisme E1.
- La vitesse de réaction croît avec la force de la base, il faudrait donc une base forte.
- Le caractère nucléofuge du groupe partant a également une influence sur la réaction, mais cette influence ne constitue pas le paramètre primordial contrairement au mécanisme d'élimination unimoléculaire (E1).
- Pour favoriser un mécanisme réactionnel d'élimination bimoléculaire E2, il est judicieux d'utiliser un solvant aprotique (DMSO, THF, toluène, n-hexane, etc.).
Concurrence[modifier | modifier le code]
Cette réaction est non seulement en concurrence avec l'E1, mais aussi avec les réactions de substitutions nucléophiles, en particulier avec la SN2, qui se produit dans des conditions similaires. À noter qu'une réaction d'élimination nécessitera plus d'énergie qu'une réaction de substitution correspondante, généralement par le biais d'un chauffage.
Remarques[modifier | modifier le code]
La base utilisée est aussi un nucléophile. Cela explique la concurrence avec les réactions de substitutions. En fin de réaction, on peut retrouver, mélangés, des produits d'éliminations et des produits de substitutions.
