Maturation d'affinité des immunoglobulines
La maturation d'affinité est un processus spécifique de la réponse immunitaire adaptative conduisant à la production par les lymphocytes B d'immunoglobulines d'affinité croissante pour l'antigène.
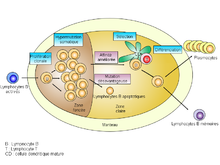
Contexte[modifier | modifier le code]
Quand ?[modifier | modifier le code]
La réponse immunitaire primaire connait deux phases en deux temps différés:
- La phase T indépendante correspond à la réponse immédiate des lymphocytes B qui sécrètent uniquement des immunoglobulines de classe M et D ayant une faible affinité pour l'antigène[1].
- La phase T dépendante correspond à la réponse après un temps de latence des lymphocytes B qui, après commutation de classe, sécrètent des immunoglobulines de classe A, E ou G ayant une forte affinité pour l'antigène grâce à la maturation d'affinité, qui a lieu entre la deuxième et la troisième semaine de la réponse immunitaire[1],[2].
Localisation[modifier | modifier le code]
Le phénomène de maturation d'affinité se déroule dans les organes lymphoïdes secondaires au sein de centres germinatifs qui sont des structures spécialisées se formant suite à l'activation des lymphocytes B par leur antigène et à la coopération avec les lymphocytes T auxiliaires dans les organes lymphoïdes secondaires[3].
Mécanismes[modifier | modifier le code]
Activation des lymphocytes B[modifier | modifier le code]
Les lymphocytes B entrent en contact avec l'antigène, le dégradent et le présentent sous forme de peptides sur le complexe majeur d'histocompatibilité de classe II aux lymphocytes T auxiliaires activés[4]. L'interaction entre CD40 du lymphocyte B activé et le CD40 ligand sur le lymphocyte T auxiliaire est essentielle pour provoquer la migration des cellules B fondatrices vers un follicule lymphoïde, qui évolue ainsi en centre germinatif[5]. Cette interaction va également engendrer l'expression de l'enzyme AID (activation induced desaminase) qui va avoir un rôle majeur dans le processus d'hypermutation somatique.
Prolifération clonale[modifier | modifier le code]
Le centre germinatif est divisé en deux zones, une claire et une foncée. Les cellules B entrent dans la zone foncée. Elles expriment alors peu d'immunoglobulines à leur surface et se multiplient toutes les 6 à 8 heures. On les appelle des centroblastes[6]. C'est l'étape de prolifération clonale.
Hypermutation somatique[modifier | modifier le code]
Les centroblastes ralentissent leurs divisions et expriment davantage d'immunoglobulines de classe M à leur surface. On les appelle alors des centrocytes[2]. Ils subissent des mutations ponctuelles sur les régions variables des gènes réarrangés codant les chaînes lourdes et légères des immunoglobulines grâce à l'enzyme AID[5]. Elle convertit la cytosine de l'ADN en uracile. Cette présence anormale d'uracile dans l'ADN entraine l'action de différents systèmes de réparation de l'ADN. Ces mutations ne touchent qu'un centrocyte sur deux à chaque division, seulement sur un nucléotide en général et préférentiellement au niveau des zones hypervariables des immunoglobulines. Elles ont pour but d'obtenir l'expression de récepteurs B mutés d'affinité modifiée qui nécessitent donc un processus de sélection des meilleurs récepteurs[6]. Elles sont cependant en grande partie infructueuses et provoquent l'apoptose des centrocytes. Mais, pour les centrocytes exprimant une immunoglobuline à l'issue du processus d'hypermutation, la sélection se poursuit dans la zone claire des centres germinatifs.
Sélection des clones B producteurs d'immunoglobulines de haute affinité[modifier | modifier le code]
La sélection des immunoglobulines se fait à l'aide des cellules folliculaires dendritiques.
Les cellules folliculaires dendritiques sont des cellules particulières des follicules lymphoïdes ayant une morphologie spécifique adaptée à leur fonction. Elles sont composées d'un petit noyau autour duquel sont axés de nombreux prolongements cellulaires, et forment un réseau leur permettant de capter et de maintenir les antigènes sous forme de complexes immuns au sein d'unités appelées iccosomes[6].
Les lymphocytes B qui ont survécu à l'étape d'hypermutation se déplacent sur le réseau que forment les cellules folliculaires dendritiques afin de tester leur nouveau récepteur[1]. Lors de cette étape, le lymphocyte B capture l'antigène et le présente à sa surface sous forme de peptide sur un complexe majeur d'histocompatibilité de classe II, et il reçoit dans le même temps un signal de survie[6]. Il y a donc une compétition entre les lymphocytes B pour la fixation à la cellule folliculaire dendritique, et ce sont les niveaux d'affinité de leur récepteur pour les antigènes qui vont les différencier. Il existe aussi une compétition entre lymphocytes B due à la proximité de ceux-ci les uns par rapport aux autres[6]. Les lymphocytes de haute affinité vont capturer les antigènes des lymphocytes de faible affinité avant que ceux-ci n'aient le temps de les internaliser. Les lymphocytes B de haute affinité vont donc présenter beaucoup plus d'antigènes à leur surface que ceux de faible affinité.
Différenciation terminale[modifier | modifier le code]
À l'issue du processus de sélection, les lymphocytes B coopèrent avec les lymphocytes T auxiliaires folliculaires, ce qui donne lieu à une nouvelle compétition favorisant les lymphocytes présentant le plus de complexe CMH/peptide à leur surface[6]. Lors de cette interaction, le lymphocyte T auxiliaire envoie un signal de survie en activant l'expression de la protéine Bcl-xL chez le lymphocyte B[5]. Puis il engendre leur prolifération et leur différenciation en plasmocytes sécréteurs ou à longue vie ou en lymphocytes B mémoires avant qu'ils ne rejoignent la circulation lymphatique, puis la circulation sanguine[4].
Fonction[modifier | modifier le code]
Ce processus de maturation permet d'augmenter l'affinité respective des lymphocytes B pour leur antigène et de sélectionner les meilleures immunoglobulines. Cela augmente par conséquent l'efficacité de la réponse immunitaire[2]. La réaction folliculaire conditionne la différenciation des lymphocytes B en lymphocytes B mémoires et en plasmocytes à longue vie, ce qui est essentiel pour une réponse immunitaire protectrice à long terme[1]. Le principe de la vaccination repose sur ce phénomène, en permettant la production d'anticorps neutralisants via la stimulation par un antigène sous une forme non-dangereuse.
Notes et références[modifier | modifier le code]
- Noëlle Genetet, Immunologie 4e édition, Editions Médicales internationales, 2002, 2-740-0528-9, pages 428, 132, 118
- David Male, Jonathan Brostoff, David B.Roth, Ivan Roitt, Immunologie 7e édition, Elsevier Masson, Campus référence, 2007, 2-84299-841-7, pages 190 à 195
- Serge Jacquot, Olivier Boyer, 2006, Hétérogénéité et fonctions des lymphocytes B chez l'homme, medecine/sciences, volume22, N°12
- Les lymphocytes B entrent en contact avec l'antigène, le dégradent et le présentent sous forme de peptides sur le complexe majeur d'histocompatibilité de classe II aux lymphocytes T auxiliaires activés
- Peter Parham, Le système immunitaire, Editions De Boeck, 2003, 2-7445-0146-8, pages 166 à 169
- Christopher D.C. Allen, Takaharu Okada and Jason G.Cyster, 2007, Germinal-CenterOrganization and Cellular Dynamics, Immunity
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Christopher D.C. Allen, Takaharu Okada and Jason G.Cyster, 2007, Germinal-CenterOrganization and Cellular Dynamics, Immunity
- Serge Jacquot, Olivier Boyer, 2006, Hétérogénéité et fonctions des lymphocytes B chez l'homme, medecine/sciences, volume22, N°12
- David Male, Jonathan Brostoff, David B.Roth, Ivan Roitt, Immunologie 7e édition, Elsevier Masson, Campus référence, 2007, 2-84299-841-7, pages 190 à 195
- Noëlle Genetet, Immunologie 4e édition, Éditions Médicales internationales, 2002, 2-740-0528-9, pages 428, 132, 118
- Ivan Roitt, Jonathan Brostroff, David Male, Immunologie 3e édition, Editions De Boeck université, 2002, 2-8041-4057-1, pages 132 à 141
- Peter Parham, Le système immunitaire, Editions De Boeck, 2003, 2-7445-0146-8, pages 166 à 169
