Maladie de Crohn
| Symptômes | Douleur abdominale, fièvre, anorexie, sensation d'évacuation incomplète des selles (en), diarrhée, amaigrissement, constipation, fistule, arthralgie, aphte, ulcère, gingivite et fatigue |
|---|
| Médicament | Acide para-aminosalycilique, méthotrexate, certolizumab pegol, infliximab, budésonide, natalizumab, vedolizumab, mécasermine (en), adalimumab, azathioprine, dexaméthasone, ustekinumab, cholécalciférol, abatacept, sargramostim (en), thalidomide, naltrexone, tacrolimus, acide 5-aminosalicylique, téduglutide (en), budésonide et Stelara (d) |
|---|---|
| Spécialité | Gastro-entérologie |
| CIM-10 | K50 |
|---|---|
| CIM-9 | 555 |
| OMIM | 266600 |
| DiseasesDB | 3178 |
| MedlinePlus | 000249 |
| eMedicine |
172940 ped/507 radio/197 |
| MeSH | D003424 |
| Patient UK | Crohns-disease-pro |
La maladie de Crohn est une maladie inflammatoire chronique de l'intestin (MICI) qui peut atteindre toute partie de l'appareil digestif (de la bouche à l'anus) et éventuellement la peau, les articulations et les yeux. De cause inconnue, cette maladie est caractérisée par une inflammation le plus souvent retrouvée au niveau de l'iléon et du côlon, qui serait d'origine multifactorielle, faisant intervenir entre autres une composante génétique et le microbiome.
Il s'agit d'une maladie chronique évoluant typiquement par poussées espacées par des phases dites de rémission, asymptomatiques. Les signes digestifs sont le plus souvent à type de diarrhée, de douleur abdominale ou de lésion proctologique. La prise de médicament en cas de maladie de Crohn est particulière en raison de l'altération de la paroi intestinale[précision nécessaire]. L'inflammation de cette paroi rend difficile l'absorption des médicaments à travers les villosités intestinales pour atteindre la circulation sanguine. Le diagnostic nécessite une fibroscopie œsogastrique et une coloscopie avec réalisation de biopsies. La maladie de Crohn peut aussi être détectée grâce à une vidéocapsule, celle-ci permettant de visualiser les intestins et plus particulièrement le grêle. Le traitement est surtout médical avec l'utilisation de dérivé aminosalycilé au cours des poussées et d'immunosuppresseur en entretien. Une intervention chirurgicale est parfois justifiée. L'arrêt d'un éventuel tabagisme est conseillé.
Il s'agit d'une maladie multifactorielle au même titre que la colite ulcéreuse (rectocolite hémorragique, RCH) ou la polyarthrite rhumatoïde, autres maladies proches.
Historique[modifier | modifier le code]
La maladie de Crohn pourrait avoir un lien avec un gène hérité des Néandertaliens lors de l'hybridation des deux espèces (Homo neanderthalensis et Homo sapiens)[1].
La maladie a été décrite en 1932 par Burrill Bernard Crohn (1884-1983), gastro-entérologue au Mount Sinai Hospital de New York[2].
En 1993 est signalé le cas d'une souris présentant une mutation du gène de l'interleukine 2 et atteinte de troubles digestifs proches de la maladie de Crohn[3], ce qui en fait le premier modèle animal de cette affection.
La fréquence de la maladie de Crohn semble avoir régulièrement augmenté durant la seconde moitié du XXe siècle dans les pays industriels, avec une incidence et une prévalence qui semblent commencer à se stabiliser dans les zones à forte incidence (Europe du Nord et Amérique du Nord)[4]. À l'échelle planétaire, l'incidence de la maladie de Crohn était dans les années 1980 plus importante en Europe, et nettement plus faible en Asie et en Afrique[5], mais la fréquence de la maladie continue à croître dans les zones qui semblaient relativement épargnées ou à faible incidence (Europe du Sud, Asie et dans la plupart des pays en développement)[4]. Les différences ethniques et géographiques qui étaient notées dans le passé quant à la fréquence de la maladie, s'estompent toutes[4].
Épidémiologie[modifier | modifier le code]
- incidence : la maladie de Crohn est une maladie rare, avec environ 15 à 20 cas par an et pour 100 000 personnes[6] ; environ 1,4 million de personnes en souffrent aux États-Unis et 2,2 millions de personnes en Europe.
- prévalence : elle est d'environ 140 pour 100 000[4]. On estime à 200 000 le nombre de patients touchés en France en 2011, et à 80 000 au Canada en 2006[7].
Selon les zones géographiques et les époques, les autorités sanitaires affichent des chiffres très variables : ainsi, des épidémiologistes jugeaient que la prévalence de la maladie était comparable en Norvège (vers 1995) à celle de la maladie aux États-Unis quelques années plus tôt (vers 1985) ; soit 6 à 7,1 pour 100 000, mais la fondation Crohn's and Colitis Foundation of America évoque un taux d'environ 149 pour 100 000 pour le Canada alors que le NIH évoque une fourchette bien plus large de 28 à 199 pour 100 000 à la fin des années 1980[5],[8]. On note qu'en Europe, la maladie de Crohn est non seulement plus fréquente dans les pays nordiques (comme en Amérique), mais qu'elle est aussi plus élevée dans les zones les plus septentrionales de ces pays[9]. Il a aussi été noté que l'incidence de la maladie est plus élevée chez les Juifs ashkénazes[10],[11].
Distribution selon l'âge[modifier | modifier le code]
La distribution selon l'âge est bimodale. La maladie, très rarement diagnostiquée durant la petite enfance, tend à toucher plus souvent le groupe des adolescents et des jeunes adultes (20-30 ans) puis des personnes plus âgées (50-70 ans).
Une sous-estimation du nombre de malades pourrait exister en raison d'un risque de confusion de maladie de Crohn avec un syndrome de l'intestin irritable[10],[12].
Influence du sexe[modifier | modifier le code]
La maladie de Crohn affecte habituellement plus sévèrement les jeunes femmes que les jeunes hommes[13] bien que le taux de femmes atteintes par la maladie soit à peine plus grand que celui des hommes touchés[14].
Causes[modifier | modifier le code]
Génétiques[modifier | modifier le code]
La génétique joue un rôle (qui pourrait impliquer l'autophagie[15],[16],[17],[18]), notamment démontré par :
- le modèle animal (souris) ;
- le fait que chez l'humain il existe un facteur de risque « familial »[19], les parents, les frères et sœurs ou les enfants de personnes atteintes de la maladie de Crohn sont 3 à 20 fois plus susceptibles de développer la maladie[20] ;
- les études de jumeaux qui montrent une concordance de plus de 50-55 % pour la maladie de Crohn[21],[22].
La première mutation à avoir été associée à la maladie de Crohn est un décalage du cadre de lecture du gène NOD2 (également connu sous le nom de gène CARD15)[23], cette découverte a été suivie de la mise en évidence de mutations ponctuelles[24]. Plus de trente gènes ont depuis été associés à la maladie de Crohn. La plupart de ces gènes est associée à une fonction biologique connue. Par exemple, des mutations du gène XBP1 sont impliquées dans la voie de réponse protéique dépliée du réticulum endoplasmique[25],[26]. Des variantes génétiques de NOD2 / CARD15 semblent être liées à l'atteinte de l'intestin grêle[27]. D'autres gènes bien documentés qui augmentent le risque de développer la maladie de Crohn sont ATG16L1[28], IL23R[29], IRGM[30] et SLC11A1[31]. Il y a un chevauchement considérable entre les locus de susceptibilité aux MICI et aux infections mycobactériennes[32]. Des études récentes d'association pangénomique ont montré que la maladie de Crohn est génétiquement liée à la maladie cœliaque (intolérance au gluten)[33],[34].
Le risque de transmettre la maladie à son enfant est multiplié par 10 à 15 si un parent est affecté (toutefois, il s'agit d'un risque relatif par rapport à une population non atteinte, le risque absolu reste limité). Les dernières hypothèses (en 2007) évoquent au moins 32 facteurs de risque génétique[35] (plusieurs gènes potentiellement responsables ont été identifiés notamment NOD2 (CARD15))[36]. En 2011, selon l'INSERM, les variations de près de 70 gènes pourraient être en cause et notamment certains par effet indirect ; les mutations du gène IRGM seraient responsables d'une augmentation du nombre des bactéries intestinales qui induirait une inflammation chronique[37].
Facteurs environnementaux[modifier | modifier le code]
La qualité de l'alimentation, l'utilisation de contraceptifs oraux, des infections périnatales ou de l'enfance, des infections à mycobactéries atypiques sont évoqués, et restent à confirmer ou infirmer par les progrès de l'épidémiologie[4].
La maladie est en forte progression en Asie ; comprendre pourquoi permettrait de mieux comprendre les causes de la maladie[38],[39].
- Modification générale du contexte immunitaire : les modes de vie modernes liés à l'urbanisation, l'industrialisation et aux nouveaux comportements ont fait disparaître certains facteurs environnementaux immunorégulateurs. Ceci explique en partie une multiplication des maladies auto-immunes dans les pays riches[40] (voir aussi maladie liée au mode de vie).
Un statut social, économique, éducatif ou professionnel élevé augmente le risque d'inflammation intestinale chronique, corroborant l'hypothèse du rôle d'une hygiène trop poussée (impliquant une moindre exposition aux micro-organismes notamment dans l'enfance) dans l'apparition des maladies allergiques et auto-immunes[41]. Une étude sur l'hypothèse hygiéniste a porté sur les « moins de 20 ans » atteints de la maladie de Crohn, avec des résultats contredisant plutôt cette hypothèse : la fréquentation d'une crèche les six premiers mois de la vie, la présence d'un animal à la maison et des infections diagnostiquées par un médecin entre 5 et 10 ans augmenteraient le risque alors que l'utilisation régulière d'une serviette personnelle et un nombre de personnes réduit dans les maisons étaient plutôt associés à un risque réduit d'apparition de la maladie[42].
- Le tabagisme[43],[44] et l'appendicectomie sont des facteurs environnementaux associés à un risque accru de maladie de Crohn et à une augmentation de la gravité des symptômes dans le cas du tabagisme.
- Certains médicaments, tels que l'aspirine, sont suspectés de déclencher des crises[45]; pour cela, le paracétamol est toujours à préférer à l'aspirine.
- L'augmentation de la consommation de protéines animales et des ratios accrus d'acides gras polyinsaturés oméga-6 / oméga-3 (dont protéines de lait) et une modification de la proportion des oméga-6 par rapport aux oméga-3 dans l'alimentation japonaise pourraient aussi être en cause[46]. Les individus consommant des protéines végétales (ou de poissons) semblent mieux protégés contre cette maladie[46].
- Le microbiote intestinal de patients atteints de la maladie de Crohn montre une modification du rapport Firmicutes/Bacteroidetes, avec un rapport qui s’échelonne de 1/1 à 3/1 au lieu de 10/1 chez le sujet sain. On constate un déficit marqué du groupe Firmicutes, à la fois en nombre d’espèces et en proportion[47]. La bactérie Faecalibacterium prausnitzii serait absente ou en très faible quantité dans le microbiote intestinal des malades de Crohn[48].
- Le microbiote modifie le métabolisme des purines et la production d'acide urique, deux facteurs pouvant affecter la fonction intestinale : chez la souris de laboratoire un champignon faisant partie du mycobiote intestinal exacerbe la colite[49] et la perméabilité intestinale. Des anticorps sont anormalement dirigés contre la levure Saccharomyces cerevisiae (ASCA) qui fait partie du mycobiote (au sein du microbiote commensal de l'humain) et il est démontré chez la souris qu'une colonisation accrue de l'intestin par cette levure exacerbe la colite en augmentant le métabolisme des purines ce qui se traduit par une dégradation de l'épithélium intestinal ; une telle corrélation a aussi été trouvée dans le sérum humain[49].
En laboratoire, l'allopurinol (médicament qui bloque la voie purine) inverse ces dommages.
Le transcriptome du tissu du côlon provenant de souris sans germes inoculés montre qu'un autre microchampignon de l'intestin (Rhodotorula aurantiaca) peut avoir le même effet[49].
Un screening métabolomique fécal d'animaux de laboratoire sans germes a confirmé que ces microchampignons du mycobiote, en dopant le métabolisme de la purine de l'hôte, y augmentaient aussi l'acide urique, ce qui aggrave la maladie de Crohn[49].
- L'introduction de la contraception hormonale aux États-Unis dans les années 1960 est associée à une augmentation spectaculaire de l'incidence. Une hypothèse est qu'elle affecte le système digestif (comme le tabagisme).
- L'isotrétinoïne est associée à la maladie de Crohn[50],[51],[52].
Facteurs psychologiques[modifier | modifier le code]
Le stress est un facteur important dans l'apparition des maladies inflammatoires chroniques de l'intestin[41]. Bien que le stress soit parfois suspecté d'exacerber la maladie de Crohn, il n'existe aucune preuve concrète[53]. Une étude de 1985 s'est intéressée au profil psychologique de malades atteints de Crohn et de rectocolite hémorragique. L'étude a conclu que les individus observés ne présentaient pas de traits de personnalité particuliers. L'étude a également permis de confirmer que les symptômes de nervosité, de dépression et d'instabilité émotionnelle, qui sont observés régulièrement lors des phases de poussée de la maladie, étaient absents lors des phases de rémission[54],[55],[56],[57]. En 2019 Ghia et al. ont décrit que les facteurs de type dépressif utilisés dans un modèle murin (souris) présentant plusieurs signes distinctifs de maladie de Crohn, peuvent augmenter l’inflammation du côlon[58],[59].
Localisation des lésions[modifier | modifier le code]
Cette maladie peut toucher toutes les parties du tube digestif. Trois zones sont plus souvent atteintes[60] :
- la partie terminale de l’intestin grêle (l’iléon),
- le côlon,
- la zone anopérinéale[61], incluant de possibles fistules[62].
Une localisation dans la partie haute du tube digestif œso-gastro-duodénale est également assez fréquente[63],[64].
Symptômes[modifier | modifier le code]
Les symptômes de la maladie de Crohn se manifestent par poussées alternant avec des phases de rémission. Le principal symptôme (lors des poussées) est une douleur abdominale qui s'accentue après les repas, accompagnée de diarrhées chroniques, notamment par malabsorption des acides biliaires. On observe souvent aussi de la fièvre, une fatigue persistante ou une perte de poids (par malabsorption).
Les symptômes varient selon la localisation des lésions. Les symptômes des localisations hautes sont : dysphagie, douleur en mangeant, nausées ou vomissements (rarement avec hématémèse ou méléna[65]), et aphtes dans la bouche, avec souvent une perte de poids et une hypoalbuminémie.
D'autres symptômes se manifestent hors du système digestif :
- atteintes rénales (calculs rénaux, coliques néphrétiques),
- atteintes articulaires (spondylarthropathie), de la colonne vertébrale,
- troubles dermatologiques (érythèmes noueux, « métastases cutanées »[66] de la maladie) et des muqueuses (aphtes récidivants), atteintes vulvaires (rarement[67],[68]),
- atteintes oculaires (uvéite antérieure, épisclérite, diplopie, hypersensibilité à la lumière),
- pancréatites, éventuellement aigües[69],
- thromboses veineuses.
On utilise un indice d'activité pour savoir si la maladie est en poussée ou non, c'est l'indice de BEST[70] (CDAI pour les Anglo-Saxons). Cet indice permet de classer la maladie suivant quatre stades : maladie de Crohn inactive, poussées minimes à modérées, poussées plus sévères et poussées très sévères. On évalue l’indice suivant un questionnaire qui permettra d’obtenir un score qui désignera le stade de la maladie. Chez 30 % des patients, l'iléon (ou partie terminale du petit intestin) est colonisé par la bactérie AIEC (adherent-invasive Escherichia coli)[71].
Diagnostic[modifier | modifier le code]
Coloscopie[modifier | modifier le code]
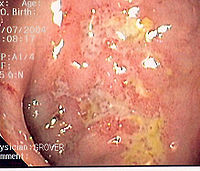
Au niveau macroscopique[modifier | modifier le code]
La visualisation directe des lésions par coloscopie est capitale pour affirmer le diagnostic. Les atteintes sont en général diffuses et discontinues, les contours flous. Les zones touchées sont typiquement le côlon et les derniers centimètres de l'iléon (on parle alors d'iléite de Crohn), mais l'ensemble du tube digestif peut être atteint. Les lésions rencontrées sont discontinues (par opposition à la rectocolite hémorragique), avec des ulcérations souvent aphtoïdes ou profondes. Elles peuvent se présenter sous forme de véritables fissures dans la muqueuse. On retrouve fréquemment des pseudo-polypes.
Une fibroscopie gastrique peut être nécessaire[72].
Au niveau microscopique[modifier | modifier le code]
Dans les biopsies de muqueuse digestive, la présence d'un granulome épithélioïde est un argument fort en faveur du diagnostic de la maladie. Cependant, il n'est pas toujours visualisé.
D'autres arguments sont en faveur d'une maladie de Crohn : un œdème et une inflammation de la paroi : infiltrat lymphoplasmocytaire, associés à des ulcérations larges et fissuraires, des abcès cryptiques, des lymphangiectasies, une inflammation périvasculaire et une hyperplasie neuronale.
Enfin, l'inflammation peut être transmurale : elle touche les différentes couches de la paroi digestive (par opposition à la rectocolite hémorragique, non transmurale). On observe entre autres la présence de follicules lymphoïdes dans toute l'épaisseur de la paroi, notamment en profondeur.
Vidéocapsule[modifier | modifier le code]
La vidéocapsule est une petite caméra vidéo que les patients avalent et qui enregistre les images du tube digestif. Son principal atout est de pouvoir visualiser l'intestin grêle qui est inaccessible à l'endoscopie.
Entéroscopie[modifier | modifier le code]
On peut également explorer l'intestin grêle à l'aide d'un entéroscope (double ballon ou simple ballon). Il s'agit d'un endoscope plus long qu'un coloscope dont la progression est facilitée par un surtube à ballon gonflable. Son intérêt par rapport à la vidéocapsule réside dans la possibilité d'intervenir sur la lésion et d'avoir une bonne précision quant à la localisation.
Radiologie[modifier | modifier le code]
L'absorption d'un liquide radioopaque permet de visualiser le tube digestif. Cet examen est utile pour observer les zones non visibles par endoscopie (en particulier l'intestin grêle). Il permet de détecter d'éventuelles sténoses (rétrécissements), fistules etc. mais il est à éviter dans les poussées sévères.
Le scanner peut aider au diagnostic, particulièrement s'il existe des fistules.
Diagnostic différentiel[modifier | modifier le code]
Le diagnostic différentiel est difficile à faire car la maladie peut avoir, à tort, été étiquetée comme un trouble fonctionnel digestif intestinal, appelé également côlon irritable.
On peut confondre facilement une rectocolite hémorragique (ne touchant que le côlon) et une maladie de Crohn (pouvant toucher tout le tube digestif), toutes deux des formes de maladies inflammatoires chroniques intestinales.
Le diagnostic peut ne pas être porté avec certitude entre ces deux entités lors des premières poussées, on parle alors de colite indéterminée. Dans la plupart des cas, l'évolution de la maladie et de ses signes cliniques permet, après plusieurs mois ou années, de finir par déterminer avec précision la maladie concernée et donc d'adapter au mieux la stratégie thérapeutique. Il arrive cependant que la colite reste indéterminée, le débat actuel étant de savoir si la cause n'est pas une troisième entité des maladies inflammatoires chroniques intestinales.
Certaines colites infectieuses peuvent aussi présenter un tableau trompeur, par exemple l'infection à Yersinia ou une tuberculose à localisation digestive.
Complications[modifier | modifier le code]
Au niveau local[modifier | modifier le code]
- Occlusion ou sub-occlusion intestinale
- Les fistules : interne et externe
- Les complications infectieuses : abcès, risquant de se perforer
- La perforation du grêle, conduisant à une péritonite
- La colectasie aiguë : dilatation du côlon pouvant être supérieure à 10 cm et entraînant un risque de perforation
- Hémorragies digestives
- Dégénérescence maligne
Au niveau général[modifier | modifier le code]
On peut parfois observer une dénutrition due à une malabsorption au niveau des lésions inflammatoires. La perte de protéines entraîne une diminution des facteurs de coagulation circulants et donc augmente le risque thromboembolique. La chronicité des symptômes, les nombreuses hospitalisations et, plus globalement, le retentissement de la maladie sur la qualité de vie peuvent entraîner des épisodes dépressifs. Enfin le traitement de la maladie est invasif et présente des effets secondaires intrinsèques.
À court terme[modifier | modifier le code]
On craint surtout les sténoses, fissures, fistules ou perforations, une colectasie (dilatation toxique du côlon) ou une colite grave (poussée très sévère d'emblée).
Risques à long terme[modifier | modifier le code]
Il existe, après dix ans d'évolution, une majoration du risque de cancer colorectal. Ce risque est surtout important en cas d'atteinte étendue et nécessite un dépistage par coloscopie totale tous les 2 ans, au-delà de 10 ans d'évolution de la maladie.
Pronostic[modifier | modifier le code]
La maladie de Crohn est une maladie chronique pour laquelle il n'y a pas de remède définitif. Elle se caractérise par des périodes d'amélioration et de rémission suivies d'épisodes où les symptômes se manifestent à nouveau. Les degrés de sévérité de la maladie peuvent varier de bénin à très sévère. Environ 15 à 20 % des personnes connaissant un épisode de poussée de la maladie de Crohn n'auront plus aucun symptôme le reste de leur vie. Avec les traitements existants, la plupart des gens conservent un poids normal et le taux de mortalité de la maladie est faible. La plupart des personnes atteintes de la maladie de Crohn ont une espérance de vie normale[73].
Les dernières recommandations européennes sur le diagnostic et le traitement de la maladie ont été publiées en 2006[74]. Les recommandations de la Société américaine de gastroentérologie datent de 2007[75].
Traitement[modifier | modifier le code]
Les causes de la maladie de Crohn restant inconnues, il n’existe aucun traitement permettant d’en guérir. Le traitement médical repose sur la réduction de l'inflammation[76]. Le traitement est basé sur deux principes : le premier consiste à traiter le malade au cours des poussées ; c’est ce que l’on appelle le traitement d’attaque. Le second principe est la prévention des rechutes. C’est le traitement d’entretien qui permet de prolonger au maximum les périodes de rémission de la maladie.
La sécurité sociale française classe la maladie de Crohn en tant qu’affection longue durée (ALD) exonérante. Elle est donc prise en charge à 100 %[77].
Traitement des poussées[modifier | modifier le code]
Le traitement d’attaque consiste à limiter les symptômes de la maladie, comme les diarrhées ou les douleurs abdominales pouvant survenir au cours des poussées.
Le traitement initial est la plupart du temps prescrit par le gastro-entérologue. Le médecin traitant participe au suivi du traitement et à la surveillance des éventuelles complications[78].
Le choix du traitement sera fait en premier lieu en fonction de l’intensité des poussées (épisodes aigus légers, modérés, sévères…) et de leur localisation. Le traitement est donc individualisé, patient par patient. Il y a quatre groupes de médicaments pouvant être utilisés en cas de poussées. Ce sont les dérivés aminosalicylés, la corticothérapie, les immunosuppresseurs d'action rapide et les anti-TNF-alpha[70],[79],[80].
Les aminosalicylés, tels que le 5-ASA (pour acide 5-aminosalicylique), exercent une action anti-inflammatoire sur la muqueuses intestinale. Ils sont généralement administrés pour traiter des poussées légères dans le cas où les lésions sont limitées à l’iléon ou au côlon. L’efficacité des aminosalicylés est réduite dans cette maladie mais ces produits sont généralement très bien tolérés. La fonction rénale est à surveiller en cas de traitement prolongé.
Pour les poussées d’intensité moyenne à sévère, on utilise principalement des corticoïdes. Ce traitement permet une amélioration rapide des symptômes. En France, la posologie la plus fréquemment administrée est de 1 mg/kg/j d’équivalent prednisolone par voie orale pendant 3 à 7 semaines. Cette dose est ensuite diminuée par paliers jusqu’à un arrêt total. Au cours de cette décroissance, 20 % à 30 % des patients ne peuvent pas être sevrés totalement de leur corticothérapie sans que l’on observe une reprise évolutive de la maladie, immédiatement ou dans les trois mois. Ce sont des patients ayant une forme dite corticodépendante de la maladie de Crohn chez qui il faudra introduire un traitement immunosuppresseur par Azathioprine.
Un immunosuppresseur d’action rapide peut également être utilisé pour traiter les poussées sévères à l’hôpital. Le médicament principalement utilisé dans ce cas est la ciclosporine. Elle permet, dans certains cas, d’éviter la chirurgie.
En cas d’échec ou de contre-indication au traitement habituel des poussées modérées à sévères ou en cas d’échec du traitement des fistules, il existe maintenant l’option du traitement par anti-TNFα.
Les anti-TNFα sont des immunomodulateurs sélectifs[80]. Ils bloquent l’expression des TNFα, qui sont de puissants médiateurs de l’inflammation et de la nécrose tissulaire. Les principaux médicaments sont l’infliximab et l’adalimumab. L’infliximab s’administre en perfusion, uniquement en usage hospitalier. L’adalimumab se présente sous forme de stylos permettant les injections à domicile. Le traitement par anti-TNFα permet généralement une amélioration des symptômes en quelques semaines. S’il n’y a pas d’amélioration au bout de douze semaines de traitement, celui-ci doit être arrêté. Ce traitement impose une surveillance accrue du risque d’infection. Cette vigilance vis-à-vis des infections doit être maintenue dans les six mois suivant l’arrêt du traitement. Il ne faut pas administrer de vaccins vivants chez un patient traité par anti-TNFα tandis que la vaccination annuelle contre la grippe est recommandée. Il est préconisé d’adopter une contraception efficace durant la durée du traitement et jusqu’à 6 mois après son arrêt. L'ustékinumab a une efficacité comparable à celle de l'adalimumab[81].
Traitement d'entretien[modifier | modifier le code]
Le traitement d’entretien a pour but de prévenir les rechutes. C’est le traitement prescrit durant les périodes de rémission, c’est-à-dire les périodes durant lesquelles le patient ne ressentira plus les symptômes de la maladie (disparition des douleurs notamment). Cette période sans symptômes n’est pas synonyme de guérison. Il est donc important pour le patient de poursuivre son traitement afin de pouvoir retarder au maximum la réapparition des poussées et maintenir une qualité de vie convenable. Le traitement d’entretien permet également de diminuer les complications[76].
Les aminosalicylés ont une efficacité limitée en traitement d’entretien[79].
Les immunosuppresseurs (sélectifs ou d’action lente) sont les traitements de choix durant la phase d’entretien. Les 2 produits les plus fréquemment utilisés sont l'azathioprine (immunosuppresseur, un analogue des purines) et l'infliximab[82], ou l’adalimumab. L’azathioprine reste le traitement de référence. Les anti-TNF-alpha (Infliximab et Adalimumab) sont de plus en plus fréquemment utilisés. Ces derniers semblent plus efficaces encore lorsqu’ils sont associés à l’azathioprine[83]. L'utilisation de certaines souches de probiotiques présente des pistes prometteuses[84],[85]. Ces souches ne semblent cependant pas présenter toutes le même intérêt thérapeutique[86].
Chirurgie[modifier | modifier le code]
Elle était la règle auparavant mais son indication décroît régulièrement[87].
Les interventions chirurgicales sont pratiquées essentiellement chez les patients pour lesquels le traitement médical se révèle inefficace ou dans le cas de certaines complications[76]. L’opération chirurgicale ne permet pas de guérir définitivement la maladie.
Il s’agit principalement de retirer les lésions inflammatoires. Cependant, ces opérations ne doivent concerner que les zones touchées résistantes aux traitements médicaux afin d’épargner au maximum l’intestin du patient. En effet, celui-ci est régulièrement éprouvé par les poussées de la maladie[78]. L’opération consiste en une ablation de la partie lésée de l’intestin suivie d’une suture entre les deux portions saines restantes. Cette opération peut nécessiter la mise en place d’une stomie intestinale (ou « anus artificiel »), le plus souvent provisoire. Après dix ans d’évolution de la maladie, on peut considérer que plus d'un malade sur deux a subi un acte chirurgical.
Recherche clinique[modifier | modifier le code]
L'antibiotithérapie est d'un effet modeste et cliniquement non significatif selon les données d'une méta-revue Cochrane[88].
Un traitement à base de naltrexone à faible dose, en anglais : Low Dose Naltrexone therapy, LDN, bénéficie de quelques essais cliniques de faibles effectifs[89],[90].
Des traitements expérimentaux par transplantation de microbiote intestinal d'un patient sain à une personne malade (après destruction du microbiote intestinal du patient malade) sont testés en France et aux États-Unis[91]. Une bactérie serait absente du microbiote intestinal des malades[92].
En 2012, le Grenoble-Institut des neurosciences a commencé une expérimentation par neurostimulation afin de traiter la maladie de Crohn en réduisant l'inflammation des tissus atteints du système digestif[93]. Les résultats montrent que cette technique est une alternative intéressante pour les patients dont la maladie est modérée.
En 2015, la protéine P28GST, une protéine d'origine parasitaire qui agirait sur le système immunitaire, est à l'étude[94].
Le potentiel de l'anticorps monoclonal Risankizumab est en cours d'évaluation[95].
Règles hygiéno-diététiques[modifier | modifier le code]
Régime alimentaire[modifier | modifier le code]
Alors que les connaissances et les publications scientifiques ne permettent pas d'établir de recommandations diététiques sur des faits probants[96],[97], lors des poussées, un régime sans fibres (c'est-à-dire sans fruits, sans légumes et sans céréales) est généralement mis en place afin de ne pas aggraver les symptômes (diarrhée, douleur…). Il est important de boire suffisamment afin de compenser les pertes en eau dues aux diarrhées. Dès que l’état de santé s’améliore (rémission), il est conseillé d'arrêter ce régime. En dehors des poussées, il est important de conserver une alimentation la plus équilibrée et la plus variée possible. En effet, cela pourrait prévenir la dénutrition et les carences constatées chez certains patients. Les fruits et légumes doivent être réintégrés dans l’alimentation[79].
Une supplémentation en omega 3 ou des supports nutritionnels par voie entérale ont été proposés sans preuve d'efficacité suffisante dans les études. Il en est de même pour l'utilisation de probiotique[98].
Certains changements dans le mode de vie peuvent réduire les symptômes, y compris des ajustements alimentaires, une bonne hydratation ainsi qu'un sevrage tabagique. Les régimes qui comprennent des niveaux plus élevés de fibres et de fruits sont associés à un risque réduit, tandis que les régimes riches en graisses totales, acides gras polyinsaturés, viande et acides gras oméga-6 peuvent augmenter le risque de maladie de Crohn[99]. Manger de petits repas fréquemment au lieu de gros repas peut également aider. Pour limiter les symptômes, il est recommandé de suivre un régime alimentaire équilibré. Une activité physique régulière, une alimentation saine et un sommeil suffisant contribuent à réduire la fatigue. Un journal alimentaire peut aider à identifier les aliments qui déclenchent les symptômes. Certaines personnes peuvent suivre un régime pauvre en fibres pour contrôler les symptômes aigus[100]. Certaines personnes trouvent un soulagement dans l'élimination de la caséine (protéine contenue dans le lait de vache) et du gluten (protéines présentes dans le blé, le seigle et l'orge) de leur régime alimentaire. Ils peuvent avoir des intolérances alimentaires spécifiques (pas des allergies)[101].
Un régime alimentaire à base d’aliments d’origine végétale a été décrit comme pouvant apporter une rémission sur un cas isolé[102],[103].
Activité physique[modifier | modifier le code]
L'exercice physique est pertinent pour les malades atteints de la maladie de Crohn[104]. L'activité physique joue un rôle important dans la modulation de la réponse aux inflammations. Le sport permet par exemple de faire diminuer les concentrations de RANTES (une cytokine inflammatoire) dans le sang[105],[106].
Arrêt du tabac[modifier | modifier le code]
L'arrêt du tabac est conseillé car cela peut influer favorablement sur l'évolution de la maladie[107],[108],[109],[110].
Coût économique[modifier | modifier le code]
Il est estimé à près de 30 millions de livres par an en Grande-Bretagne, pays qui compte 90 000 patients atteints de cette maladie[111].
Personnalités atteintes de la maladie de Crohn[modifier | modifier le code]
- Peut-être le roi Alfred le Grand de Wessex (871-899)[112]
- Louis XIII[113]
- Jean-Eudes Demaret[114]
- Shannen Doherty[115]
- Mike McCready[116]
- Pete Davidson
- Mark Millar[117]
- Mary Ann Mobley[118]
- Anastacia Newkirk[119],[120]
- Daryl Palumbo[121]
- Mark Reale[122]
- Dwight Eisenhower
- Fred Burguière, cofondateur du groupe Les Ogres de Barback[123]
- Le prince Albert de Saxe-Cobourg-Gotha, époux de la reine Victoria
- Kathleen Baker, nageuse américaine[124]
- Lili Boulanger, compositrice française (1893-1918)[125]
- Larry Nance Jr., Joueur de NBA [126]
- MrBeast, vidéaste Web américain[127]
- Sacha Dhawan, acteur britannique d'origine Indienne diagnostiqué en 2010.
Divers[modifier | modifier le code]
La maladie de Crohn chez un parent augmente le risque d'autisme chez ses enfants[modifier | modifier le code]
Certaines données laissaient penser que des maladies inflammatoires de l'intestin (MII) parentales pourraient prédisposer l'enfant à l'autisme, mais sans preuve concluantes jusqu'en 2021.
Un article de Aws Sadik et Coll. (paru dans Nature en juillet 2022) a finalement prouvé ce lien. Les auteurs ont combiné quatre approches complémentaires, ayant chacune une méthodologies propre pour détecter une éventuelle associations entre les MICI parentales et le risque d'autisme chez leurs enfants. Chacune des quatre approches a pris soin d'élucider l'étiologie de l'autisme pour exclure les cas d'origine génétique[128].
- Une étude de cohorte nationale basée sur la population suédoise et les registres suédois a conclu à des preuves d'associations entre les diagnostics parentaux de MII et l'autisme chez les enfants[128].
- Les analyses des scores de risque polygénique de l'étude longitudinale Avon sur les parents et les enfants ont suggéré des associations entre la responsabilité génétique maternelle envers les MII et les traits autistiques chez les enfants[128].
- Des analyses de randomisation mendélienne à deux échantillons ont fourni des preuves d'un effet causal potentiel de la responsabilité génétique aux MII, en particulier la colite ulcéreuse, sur l'autisme[128].
- La régression du score de déséquilibre de liaison n'a pas indiqué de corrélation génétique entre les MII et l'autisme[128].
En triangulant les preuves de ces quatre approches, les auteurs estiment « avoir trouvé des preuves d'un lien de causalité potentiel entre les MICI parentales, en particulier maternelles, et l'autisme chez les enfants. Un dérèglement immunitaire périnatal, une malabsorption des micronutriments et une anémie peuvent être impliqués »[128].
BD[modifier | modifier le code]
En 2015, le dessinateur de bandes dessinées Pozla, atteint de la maladie de Crohn, raconte sa propre hospitalisation dans un long album-témoignage : Carnet de santé foireuse[129]. Ce livre, primé par un Fauve d'or au festival d’Angoulême 2016, raconte, avec humour mais sans concession, son parcours médical et apporte un regard original sur cette affection.
Les Nuits De Crohn[modifier | modifier le code]
Depuis 2013, des vidéastes francophones et des personnalités du monde des jeux vidéo se réunissent pour un événement : Les Nuits De Crohn[130]. Le groupe se relaie pour filmer ses parties de jeux-vidéo en direct pendant une semaine non-stop et ainsi récolter des dons pour l'association François Aupetit[131].
Journée mondiale des MICI « World IBD Day »,[modifier | modifier le code]
La « journée mondiale des MICI » (maladies inflammatoires chroniques de l'intestin) aussi dite « World IBD Day », associée à la couleur violette est relayée en France par l'association reconnue d'utilité publique afa Crohn RCH France (depuis 2018)[132].
Modèle animal, équivalent dans le monde animal ?[modifier | modifier le code]
Les vétérinaires connaissent des maladies animales qui évoquent la maladie de Crohn, dont la paratuberculose chez les bovins (également appelée maladie de Johne) due à Mycobacterium avium subspecies paratuberculosis (MAP), qui pourrait avoir un potentiel zoonotique (à confirmer)[133].
Plusieurs modèles animaux de maladie inflammatoire de l'intestin ont été développés chez la souris de laboratoire[134].
La maladie de Crohn semble avoir été particulièrement difficile à modéliser. Récemment (2019) Caruso et al. ont décrit et utilisé un modèle murin (souris) présentant plusieurs signes distinctifs de l'inflammation intestinale typiques de la maladie de Crohn. Ces souris mutées (déficientes en NOD2/CYBB) développent spontanément une colite provoquée par un pathobionte bactérien anaérobie Gram-négatif des muqueuses intestinales[134]. Les souris mutantes ne développent cette colite qu'après le sevrage. Avant cela, elles sont protégées par des anticorps maternels[134]. Ces souris permettent d'étudier la maladie de Crohn (et confirment le rôle majeur des anticorps maternels dans la régulation de l'homéostasie immunitaire du nouveau-né).
Les auteurs voulaient savoir si la dysbiose intestinale bactérienne inflammatoire, caractéristique de la maladie de Crohn, est une cause ou une conséquence de l'inflammation intestinale. Et si la maladie de Crohn est déclenchée par une dysbiose globale ou par certaines bactéries[134] ? Ils concluent qu'en cas d'une double déficience des gènes NOD2 et de NADPH oxydase phagocyte (deux facteurs connus de susceptibilité à la MC), une pullulation de Mucispirillum chahlerler enflamme l'intestin de la souris-modèle, en raison semble-t-il d'une altération du recrutement des neutrophiles et faute de contrôle de la bactérie par les neutrophiles de la lumière. Un microbe intestinal spécifique pourrait donc déclencher une maladie de type CD en présence d'une clairance altérée de la bactérie due à l'immunité innée[134].
Notes et références[modifier | modifier le code]
- « Des gènes néandertaliens inégalement répartis », sur pourlascience.fr, (consulté le ).
- (en) Crohn BB, Ginzburg L, Oppenheimer GD, Regional ileitis, a pathologic and clinical entity, JAMA, 1932;99:1323-9.
- (en) Sadlack B, Merz H, Schorle H, Schimpl A, Feller AC, Horak I, Ulcerative colitis-like disease in mice with a disrupted interleukin-2 gene, Cell, 1993;75(2):253-261
- (en) Loftus EV Jr. « Clinical epidemiology of inflammatory bowel disease: incidence, prevalence, and environmental influences » Gastroenterology 2004;126:1504-17. .
- (en) Hiatt, Robert A.; Leon Kaufman (1988). "Epidemiology of inflammatory bowel disease in a defined northern California population" . Western Journal of Medicine 149 (5): 541–6. PMC 1026530 . .
- Le Larousse Médical, Paris, Larousse, , 1113 p. (ISBN 978-2-03-586747-6, lire en ligne), Crohn (maladie de).
- (en) Bernstein CN, Wajda A, Svenson LW, MacKenzie A, Koehoorn M, Jackson M, Fedorak R, Israel D, Blanchard JF., « The epidemiology of inflammatory bowel disease in Canada: a population-based study », Am J Gastroenterol., vol. 101, no 7, , p. 1559-68. (PMID 16863561).
- (en) Moum, B.; M. H. Vatn, A. Ekbom, E. Aadland, O. Fausa, I. Lygren, N. Stray, J. Sauar, T. Schulz (1996). « Incidence of Crohn's disease in four counties in southeastern Norway, 1990-93. A prospective population-based study. The Inflammatory Bowel South-Eastern Norway (IBSEN) Study Group of Gastroenterologists » Scandinavian Journal of Gastroenterology 31 (4): 355–61. doi:10.3109/00365529609006410 . .
- (en) Shivananda, S.; J. Lennard-Jones, R. Logan, N. Fear, A. Price, L. Carpenter and M. van Blankenstein (1996). "Incidence of inflammatory bowel disease across Europe: is there a difference between north and south? Results of the European Collaborative Study on Inflammatory Bowel Disease (EC-IBD)". Gut 39 (5): 690–7. doi:10.1136/gut.39.5.690 . PMC 1383393 . .
- (en) Baumgart, Daniel C; Sandborn, William J (2012). "Crohn's disease". The Lancet 380 (9853): 1590–605. doi:10.1016/S0140-6736(12)60026-9 . .
- (en) Yang H, McElree C, Roth MP. et al. « Familial empirical risks for inflammatory bowel disease: differences between Jews and non-Jews » Gut 1993;34:517-24. .
- (en) Crohn Disease avec eMedicine
- (en) "Crohn's disease manifests differently in boys and girls" . Crohn's and Colitis Foundation of America (en).
- (en) "Who is affected by Crohn's disease" . [Healthwise].
- (en) Marcuzzi A, Bianco AM, Girardelli M, Tommasini A, Martelossi S, Monasta L, Crovella S. « Genetic and functional profiling of Crohn's disease : autophagy mechanism and susceptibility to infectious diseases » Biomed Res Int. 2013; 2013:297501. .
- (en) Marcuzzi A, Bianco AM, Girardelli M, Tommasini A, Martelossi S, Monasta L, Crovella S. « Genetic and functional profiling of Crohn's disease: autophagy mechanism and susceptibility to infectious diseases » Biomed Res Int. 2013; 2013:297501. .
- (en) Fritz T, Niederreiter L, Adolph T, Blumberg RS, Kaser A. « Crohn's disease: NOD2, autophagy and ER stress converge » Gut 2011;60(11):1580-8. .
- (hu) Lapis K. « A bélnyálkahártyahám barrier- és autophagiás funkciózavarainak szerepe a Crohn-betegség patogenezisében [Barrier- and autophagic functions of the intestinal epithelia: role of disturbances in the pathogenesis of Crohn's disease »] Orv Hetil. 2010;151(40):1645-55. .
- Halme L, Paavola-Sakki P, Turunen U, Lappalainen M, Farkkila M, Kontula K. « Family and twin studies in inflammatory bowel disease » World J Gastroenterol. 2006;12(23):3668-72. .
- (en) Satsangi J, Jewell DP, Bell JI. « The genetics of inflammatory bowel disease » Gut 1997;40(5):572–4. PMC 1027155 . .
- Tysk C, Lindberg E, Järnerot G, Flodérus-Myrhed B (1988). Ulcerative colitis and Crohn's disease in an unselected population of monozygotic and dizygotic twins. A study of heritability and the influence of smoking . Gut 29 (7): 990–6. doi:10.1136/gut.29.7.990 . PMC 1433769 . .
- (en) Halfvarson J, Bodin L, Tysk C, Lindberg E, Järnerot G. « Inflammatory bowel disease in a Swedish twin cohort: a long-term follow-up of concordance and clinical characteristics » Gastroenterology. 2003 Jun;124(7):1767-73. (résumé)
- (en) Yasunori Ogura, Denise K. Bonen, Naohiro Inohara et Dan L. Nicolae, « A frameshift mutation in NOD2 associated with susceptibility to Crohn's disease », Nature, vol. 411, no 6837, , p. 603–606 (ISSN 1476-4687, DOI 10.1038/35079114, lire en ligne, consulté le ).
- (en) Andrew P. Cuthbert, Sheila A. Fisher, Muddassar M. Mirza et Kathy King, « The contribution of NOD2 gene mutations to the risk and site of disease in inflammatory bowel disease », Gastroenterology, vol. 122, no 4, , p. 867–874 (DOI 10.1053/gast.2002.32415, lire en ligne, consulté le ).
- (en) Arthur Kaser, Ann-Hwee Lee, Andre Franke et Jonathan N. Glickman, « XBP1 Links ER Stress to Intestinal Inflammation and Confers Genetic Risk for Human Inflammatory Bowel Disease », Cell, vol. 134, no 5, , p. 743–756 (DOI 10.1016/j.cell.2008.07.021, lire en ligne, consulté le ).
- (en) Hans Clevers, « Inflammatory Bowel Disease, Stress, and the Endoplasmic Reticulum », New England Journal of Medicine, vol. 360, no 7, , p. 726–727 (ISSN 0028-4793, PMID 19213688, DOI 10.1056/NEJMcibr0809591, lire en ligne, consulté le ).
- (en) Severine Vermeire, « NOD2/CARD15: relevance in clinical practice », Best Practice & Research Clinical Gastroenterology, vol. 18, no 3, , p. 569–575 (DOI 10.1016/j.bpg.2003.12.008, lire en ligne, consulté le ).
- (en) Natalie J. Prescott, Sheila A. Fisher, Andre Franke et Jochen Hampe, « A Nonsynonymous SNP in ATG16L1 Predisposes to Ileal Crohn’s Disease and Is Independent of CARD15 and IBD5 », Gastroenterology, vol. 132, no 5, , p. 1665–1671 (DOI 10.1053/j.gastro.2007.03.034, lire en ligne, consulté le ).
- (en) Julia Diegelmann, Darina Czamara, Emmanuelle Le Bras et Eva Zimmermann, « Intestinal DMBT1 Expression Is Modulated by Crohn’s Disease-Associated IL23R Variants and by a DMBT1 Variant Which Influences Binding of the Transcription Factors CREB1 and ATF-2 », PLOS ONE, vol. 8, no 11, , e77773 (ISSN 1932-6203, DOI 10.1371/journal.pone.0077773, lire en ligne, consulté le ).
- (en) Natalie J. Prescott, Katherine M. Dominy, Michiaki Kubo et Cathryn M. Lewis, « Independent and population-specific association of risk variants at the IRGM locus with Crohn's disease », Human Molecular Genetics, vol. 19, no 9, , p. 1828–1839 (ISSN 1460-2083, PMID 20106866, PMCID PMC2850616, DOI 10.1093/hmg/ddq041, lire en ligne, consulté le ).
- (en) Irit Chermesh, Aviva Azriel, Michal Alter-Koltunoff et Rami Eliakim, « Crohn's disease and SLC11A1 promoter polymorphism », Digestive Diseases and Sciences, vol. 52, no 7, , p. 1632–1635 (ISSN 0163-2116, PMID 17385031, DOI 10.1007/s10620-006-9682-3, lire en ligne, consulté le ).
- (en) Luke Jostins, Stephan Ripke, Rinse K. Weersma et Richard H. Duerr, « Host–microbe interactions have shaped the genetic architecture of inflammatory bowel disease », Nature, vol. 491, no 7422, , p. 119–124 (ISSN 1476-4687, DOI 10.1038/nature11582, lire en ligne, consulté le ).
- (en) Marjorie M Walker et Joseph A Murray, « An update in the diagnosis of coeliac disease », Histopathology, vol. 59, no 2, , p. 166–179 (ISSN 1365-2559, DOI 10.1111/j.1365-2559.2010.03680.x, lire en ligne, consulté le ).
- (en) Dorottya Kocsis, Zsuzsanna Tóth, Ágnes A. Csontos et Pál Miheller, « Prevalence of inflammatory bowel disease among coeliac disease patients in a Hungarian coeliac centre », BMC Gastroenterology, vol. 15, (ISSN 1471-230X, PMID 26481725, PMCID PMC4612406, DOI 10.1186/s12876-015-0370-7, lire en ligne, consulté le ).
- (en) Wellcome Trust Case Control Consortium, « Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls » Nature 2007;447:661-678
- (en) J. Lamoril, J.-C. Deybach et P. Bouizegarène, « Maladie de Crohn et génétique: connaissances actuelles », Immuno-analyse & Biologie Spécialisée, vol. 22, no 3, , p. 137–150 (DOI 10.1016/j.immbio.2007.01.002, lire en ligne, consulté le ).
- « Les mutations silencieuses et leur rôle dans la maladie de Crohn » www.inserm.fr/actualites
- Nature Outlook: Inflammatory Bowel Disease (It’s a condition on the rise in Asia — but why? Follow those trying to find out, and learn how our environment influences inflammatory bowel disease in this new Outlook nature, 22 décembre 2016
- Kelly Rae Chi (2016) Epidemiology: Rising in the East ; Nature Outlook - 540, S100–S102 (22 décembre 2016) ; doi:10.1038/540S100a, publié en ligne le
- (en) Graham A. W. Rook, « Hygiene Hypothesis and Autoimmune Diseases », Clinical Reviews in Allergy & Immunology, vol. 42, no 1, , p. 5–15 (ISSN 1080-0549 et 1559-0267, DOI 10.1007/s12016-011-8285-8, lire en ligne, consulté le ).
- (en) Silvio Danese, Miquel Sans et Claudio Fiocchi, « Inflammatory bowel disease: the role of environmental factors », Autoimmunity Reviews, vol. 3, no 5, , p. 394–400 (ISSN 1568-9972, PMID 15288007, DOI 10.1016/j.autrev.2004.03.002, lire en ligne, consulté le ).
- (en) Devendra K. Amre, Philippe Lambrette, Liliane Law et Alfreda Krupoves, « Investigating the Hygiene Hypothesis as a Risk Factor in Pediatric Onset Crohn's Disease: A Case-Control Study », The American Journal of Gastroenterology, vol. 101, no 5, , p. 1005–1011 (ISSN 0002-9270, DOI 10.1111/j.1572-0241.2006.00526.x, lire en ligne, consulté le ).
- (en) Seksik P, Nion-Larmurier I, Sokol H, Beaugerie L, Cosnes J. « Effects of light smoking consumption on the clinical course of Crohn's » J Inflamm Bowel Dis. 2009;15(5):734-41. DOI 10.1002/ibd.20828.
- (en) Jacques Cosnes, « Tobacco and IBD: relevance in the understanding of disease mechanisms and clinical practice », Best Practice & Research. Clinical Gastroenterology, vol. 18, no 3, , p. 481–496 (ISSN 1521-6918, PMID 15157822, DOI 10.1016/j.bpg.2003.12.003, lire en ligne, consulté le ).
- Desalmand, « Maladie de Crohn : nouvelles du congrès américain de gastroentérologie », sur santeweb.ch (consulté le ).
- (en) R. Shoda, K. Matsueda, S. Yamato et N. Umeda, « Epidemiologic analysis of Crohn disease in Japan: increased dietary intake of n-6 polyunsaturated fatty acids and animal protein relates to the increased incidence of Crohn disease in Japan », The American Journal of Clinical Nutrition, vol. 63, no 5, , p. 741–745 (ISSN 0002-9165, PMID 8615358, lire en ligne, consulté le ).
- http://www.ifn.asso.fr/presse/petit-dej-ifn-04-09-microbiote-doc-%5Bmode-compatibilite%5D.pdf
- (en) Sokol H, Pigneur B, Watterlot L et al. « Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients » Proc Natl Acad Sci USA. 2008;16731–16736
- Tyson R. Chiaro & al. (2017) A member of the gut mycobiota modulates host purine metabolism exacerbating colitis in mice ; Science Translational Medicine 08 mars 2017: Vol. 9, Issue 380, DOI: 10.1126/scitranslmed.aaf9044
- (en) Deepa Reddy, Corey A. Siegel, Bruce E. Sands et Sunanda Kane, « Possible association between isotretinoin and inflammatory bowel disease », The American Journal of Gastroenterology, vol. 101, no 7, , p. 1569–1573 (ISSN 0002-9270, PMID 16863562, DOI 10.1111/j.1572-0241.2006.00632.x, lire en ligne, consulté le ).
- (en) E. Borobio, A. Arín, A. Valcayo et M. Iñarrairaegui, « [Isotretinoin and ulcerous colitis] », Anales Del Sistema Sanitario De Navarra, vol. 27, no 2, , p. 241–243 (ISSN 1137-6627, PMID 15381956, lire en ligne, consulté le ).
- (en) D. E. Reniers et J. M. Howard, « Isotretinoin-induced inflammatory bowel disease in an adolescent », The Annals of Pharmacotherapy, vol. 35, no 10, , p. 1214–1216 (ISSN 1060-0280, PMID 11675849, DOI 10.1345/aph.10368, lire en ligne, consulté le ).
- (en-US) « Crohn's Disease | Stress », National Institute of Diabetes and Digestive and Kidney Diseases, (lire en ligne, consulté le ).
- (de) Thomas Leibig, Eberhard Wilke et Hubert Feiereis, « Zur Persönlichkeitsstruktur von Patienten mit Colitis ulcerosa und Morbus Crohn, eine testpsychologische Untersuchung während der Krankheitsremission », Zeitschrift für Psychosomatische Medizin und Psychoanalyse, vol. 31, no 4, , p. 380–392 (lire en ligne, consulté le ).
- (en) Robertson DA, Ray J, Diamond I, Edwards JG. « Personality profile and affective state of patients with inflammatory bowel disease » Gut 1989;30(5):623-6. .
- (en) Sajadinejad MS, Asgari K, Molavi H, Kalantari M, Adibi P. « Psychological issues in inflammatory bowel disease: an overview » Gastroenterol Res Pract. 2012;2012:106502. DOI 10.1155/2012/106502.
- (en) Schoultz M, Atherton I, Hubbard G, Watson AJ. « Assessment of causal link between psychological factors and symptom exacerbation in inflammatory bowel disease: a protocol for systematic review of prospective cohort studies » Syst Rev. 2013;2:8. DOI 10.1186/2046-4053-2-8.
- (en) Jean-Eric Ghia, Patricia Blennerhassett, Ykang Deng et Elena F. Verdu, « Reactivation of Inflammatory Bowel Disease in a Mouse Model of Depression », Gastroenterology, vol. 136, no 7, , p. 2280–2288.e4 (ISSN 0016-5085 et 1528-0012, DOI 10.1053/j.gastro.2009.02.069, lire en ligne, consulté le ).
- (en) Jean-Eric Ghia, Patricia Blennerhassett et Stephen M. Collins, « Impaired parasympathetic function increases susceptibility to inflammatory bowel disease in a mouse model of depression », The Journal of Clinical Investigation, vol. 118, no 6, , p. 2209–2218 (ISSN 0021-9738, PMID 18451995, DOI 10.1172/JCI32849, lire en ligne, consulté le ).
- La maladie de Crohn : définition
- Regimbeau, J. M., Panis, Y., Valleur, P., MARTEAU, P., & de Parades, V. (2000). Les manifestations ano-périnéales de la maladie de Crohn. Revue française de gastro-entérologie, 36(351), p. 18-25. (lien Inist-CNRS)
- Fazio, V. W., Jones, I. T., Jagelman, D. G., & Weakley, F. L. (1987) , Rectourethral fistulas in Crohn's disease ; Surgery, gynecology & obstetrics, 164(2), p. 148-150.
- Jouin, H., Baumann, R., Abbas, A., Duclos, B., Weill-Bousson, M., & Weill, J. P. (1986). Les localisations œsogastroduodénales de la maladie de Crohn sont fréquentes. Gastroentérologie clinique et biologique, 10(8-9), p. 549-553.
- Lenaerts, C. R. C. C., Roy, C. C., Vaillancourt, M., Weber, A. M., Morin, C. L., & Seidman, E. (1989). High incidence of upper gastrointestinal tract involvement in children with Crohn disease. Pediatrics, 83(5), 777-781.(résumé)
- Griffiths, A. M., Alemayehu, E., & Sherman, P. (1989). Clinical features of gastroduodenal Crohn's disease in adolescents. Journal of pediatric gastroenterology and nutrition, 8(2), 166-171. (résumé)
- Sutphen, J. L., Cooper, P. H., Mackel, S. E., & Nelson, D. L. (1984). Metastatic cutaneous Crohn's disease. Gastroenterology, 86(5), 941-944.
- Fenniche, S., Mokni, M., Haouet, S., & Ben Osman, A. (1997). Maladie de Crohn vulvaire: 3 observations. In Annales de dermatologie et de vénéréologie (vol. 124, no 9, p. 629-632). Masson.
- Kremer, M., Nussenson, E., Steinfeld, M., & Zuckerman, P. (1984). Crohńs disease of the vulva. The American journal of gastroenterology, 79(5), 376-378.
- Niemela, S., Lehtola, J., Karttunen, T., & Lahde, S. (1989). Pancreatitis in patients with chronic inflammatory bowel disease. Hepato-gastroenterology, 36(3), p. 175-177.
- Maladie de Crohn, [1] La maladie de Crohn, Le Moniteur des Pharmacies, cahier II du numéro 2648, 28 octobre 2006, Qu'est-ce que la Maladie de Crohn ?
- "2017, Institu pasteru: Phage therapy effective in Chron's desease"
- Mashako, M. N. L., Cezard, J. P., Navarro, J., Mougenot, J. F., Sonsino, E., Gargouri, A., & Maherzi, A. (1989), Crohn's disease lesions in the upper gastrointestinal tract: correlation between clinical, radiological, endoscopic, and histological features in adolescents and children ; Journal of pediatric gastroenterology and nutrition, 8(4), 442-446. (résumé)
- (en) « Crohn's disease - Prognosis », sur University of Maryland Medical Center (consulté le ).
- (en) Travis SP, Stange EF, for the European Crohn’s and Colitis Organisation (ECCO), European evidence based consensus on the diagnosis and management of Crohn’s disease: current management, Gut, 2006;55(suppl 1):i1-58
- (en) Clark M, Colombel JF, Feagan BC, Fedorak RN, Hanauer SB, Kamm MA, et al. American gastroenterological association consensus development conference on the use of biologics in the treatment of inflammatory bowel disease, Gastroenterology, 2007;133:312-39
- Haute Autorité de Santé, La prise en charge de votre maladie de Crohn
- L'Assurance Maladie en ligne : combien serez-vous remboursé en cas d'ALD ? [2]
- Haute Autorité de Santé, La maladie de Crohn
- Maladie de Crohn, [3] Les MICI, Le Moniteur des Pharmacies, cahier II du numéro 2797, 10 octobre 2009, Comment traiter les MICI ?
- Parcours bon usage anti-TNFα, Guide à l'usage des professionnels de santé confrontés à des patients traités par anti-TNFα, Abbott France
- Sands BE, Irving PM, Hoops T et al. Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn's disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial, Lancet, 2022;399:2200-2211
- (en) Akobeng AK, Review article: the evidence base for interventions used to maintain remission in Crohn’s disease, Aliment Pharmacol Ther, 2008;27:11-8 DOI 10.1111/j.1365-2036.2007.03536.x.
- (en) Colombel JF, Sandborn WJ, Reinisch W, Infliximab, Azathioprine, or combination therapy for Crohn's disease, N Eng J Med, 2010;362:1383-1395
- (en) Protein peptydoglycan
- Saccharomyces boulardii induit la migration des cellules épithéliales intestinales
- (en) The Role of Probiotics in Intestinal Inflammation
- (en) Jess T, Riis L, Vind I, Winther KV, Borg S, Binder V et al. Changes in clinical characteristics, course, and prognosis of inflammatory bowel disease during the last 5 decades: a population-based study from Copenhagen, Denmark, Inflamm Bowel Dis, 2007;13:481-9
- (en) Townsend CM, Parker CE, MacDonald JK, Nguyen TM, Jairath V, Feagan BG et Khanna R, « Antibiotics for the treatment of Crohn's disease », sur cochranelibrary.com, (DOI 10.1002/14651858.CD012730.pub2).
- (en) Smith JP, Stock H, Bingaman S, Mauger D, Rogosnitzky M, Zagon IS., « Low-dose naltrexone therapy improves active Crohn's disease », Am J Gastroenterol, vol. 102, no 4, , p. 820-8 (PMID 17222320).
- (en) Smith JP, Field D, Bingaman SI, Evans R, Mauger DT., « Safety and tolerability of low-dose naltrexone therapy in children with moderate to severe Crohn's disease: a pilot study », J Clin Gastroenterol, vol. 47, no 4, , p. 339-45 (PMID 23188075, DOI 10.1097/MCG.0b013e3182702f2b).
- (en) Colman RJ, Rubin DT, « Fecal microbiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta-analysis », J Crohns Colitis, vol. 8, no 12, , p. 1569-81. (PMID 25223604, PMCID PMC4296742, DOI 10.1016/j.crohns.2014.08.006, lire en ligne [html]).
- "maladie de Crohn, une bactérie anti-inflammatoire"
- Le Figaro du 12 juillet 2015, La neurostimulation pour guérir la maladie de Crohn.
- « Un cheval de Troie contre les maladies auto-immunes », sur sante.lefigaro.fr (consulté le ).
- (en) « Induction therapy with the selective interleukin-23 inhibitor risankizumab in patients with moderate-to-severe Crohn's disease: a randomised, double-blind, placebo-controlled phase 2 study », The Lancet, vol. 389, no 10080, , p. 1699–1709 (ISSN 0140-6736, DOI 10.1016/S0140-6736(17)30570-6, lire en ligne, consulté le ).
- (en) Zachos M, Tondeur M, Griffiths AM, « Enteral nutritional therapy for induction of remission in Crohn's disease », Cochrane Database Syst Rev, no 1, , CD000542. (PMID 17253452).
- (en) Takayuki Yamamoto, « Nutrition and diet in inflammatory bowel disease », Curr Opin Gastroenterol, vol. 29, no 2, , p. 216-21. (PMID 23385526, DOI 10.1097/MOG.0b013e32835b9a40).
- A. Dignass, G. Van Assche, « The second European evidence-based consensus on the diagnosis and management of Crohn's disease: Current management », Journal of Crohn's and Colitis, 2010, volume 4, DOI 10.1016/j.crohns.2009.12.002 ([PDF] lire en ligne), p. 49
- (en) Jason K Hou, Bincy Abraham et Hashem El-Serag, « Dietary Intake and Risk of Developing Inflammatory Bowel Disease: A Systematic Review of the Literature », The American Journal of Gastroenterology, vol. 106, no 4, , p. 563–573 (ISSN 1572-0241, DOI 10.1038/ajg.2011.44, lire en ligne, consulté le ).
- (en-US) « Crohn's Disease and Inflammatory Bowel Disease: 54 Tips », WebMD, (lire en ligne, consulté le ).
- (en) Sylvia Escott-Stump, Nutrition and Diagnosis-related Care, Philadelphie, Lippincott Williams & Wilkins, , 948 p. (ISBN 978-0-7817-9845-7 et 0-7817-9845-0, lire en ligne), p. 431.
- (en) « Crohn’s Disease Remission with a Plant-Based Diet: A Case Report », sur mdpi.com, .
- « Un cas inhabituel de rémission de la maladie de Crohn », sur univadis.fr, .
- (en) Colleen P. Loudon, Victor Corroll, Janice Butcher et Patricia Rawsthorne, « The effects of physical exercise on patients with Crohn's disease », The American Journal of Gastroenterology, vol. 94, no 3, , p. 697–703 (ISSN 0002-9270, DOI 10.1111/j.1572-0241.1999.00939.x, lire en ligne, consulté le ).
- (en) Juan José García, Elena Bote, Maria D. Hinchado et Eduardo Ortega, « A single session of intense exercise improves the inflammatory response in healthy sedentary women », Journal of Physiology and Biochemistry, vol. 67, no 1, , p. 87–94 (ISSN 1138-7548 et 1877-8755, DOI 10.1007/s13105-010-0052-4, lire en ligne, consulté le ).
- (en) Giraldo E. · Garcia J.J. · Hinchado M.D. · Ortega E., « Exercise Intensity-Dependent Changes in the Inflammatory Response in Sedentary Women: Role of Neuroendocrine Parameters in the Neutrophil Phagocytic Process and the Pro-/Anti-Inflammatory Cytokine Balance », Neuroimmunomodulation, (DOI 10.1159/000212384, lire en ligne).
- A. Dignass, G. Van Assche, « The second European evidence-based consensus on the diagnosis and management of Crohn's disease: Current management », Journal of Crohn's and Colitis, 2010, volume 4, DOI 10.1016/j.crohns.2009.12.002 ([PDF] lire en ligne), p. 40
- (en) Johnson GJ, Cosnes J, Mansfield JC, « Review article: smoking cessation as primary therapy to modify the course of Crohn's disease », Aliment Pharmacol Ther, vol. 21, no 8, , p. 921-31. (PMID 15813828, DOI 10.1111/j.1365-2036.2005.02424.x, lire en ligne [html]).
- (en) Nos P, Domènech E, « Management of Crohn's disease in smokers: is an alternative approach necessary? », World J Gastroenterol, vol. 17, no 31, , p. 3567-74. (PMID 21987601, PMCID PMC3180011, DOI 10.3748/wjg.v17.i31.3567, lire en ligne [html]).
- http://www.med.univ-rennes1.fr/etud/hepato-gastro/MICI.htm
- (en) Bassi A, Dodd S, Williamson P, Bodger K. « Cost of illness of inflammatory bowel disease in the UK: a single centre retrospective study » Gut 2004;53:1471-8. .
- (en) D. Pratt, « The illnesses of King Alfred the Great », Anglo-Saxon England, vol. 30, 2001, p. 39-90.
- Jean-Christian Petitfils, Louis XIII, Perrin, 2008, p. 849.
- « Saison finie pour Demaret », sur eurosport.fr, (consulté le ).
- Biographie IMDb
- (en) Chang, Young. "Pearl Jam Guitarist to Tell of Life With Crohn's". The Seattle Times. 13 mai 2003
- (en) "It's A Marvel I'm Still Alive". Sunday Mail. 4 janvier 2009
- (en) annhauprich.com
- Article Tribune de Genève, Tribune de Genève
- Biographie officielle
- (en) Glassjaw Cancel Tour Dates Over Palumbo Crohn’s Disease, 3 octobre 2002, Rockdirt
- [4]
- [5]
- (en) Karen Crouse, « Swimmer Kathleen Baker Overcomes Crohn’s Disease to Become an Olympian », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le ).
- (en) « Radio New Zealand : Concert : Programmes : Composer of the Week », sur Radio New Zealand (consulté le ).
- « NBA. Cleveland : atteint de la maladie de Crohn, Larry Nance Jr. confie sa « peur » de rejouer », sur Ouest-France.fr, (consulté le ).
- « My Problems », sur Youtube.com.
- (en) Aws Sadik, Christina Dardani, Panagiota Pagoni et Alexandra Havdahl, « Parental inflammatory bowel disease and autism in children (CC-BY-SA 4.0) », Nature Medicine, vol. 28, no 7, , p. 1406–1411 (ISSN 1546-170X, DOI 10.1038/s41591-022-01845-9, lire en ligne, consulté le )
- Pozla., Carnet de santé foireuse, Paris, Delcourt (ISBN 978-2-7560-6639-4, OCLC 958152510).
- « J'ai la maladie de Crohn: on a reçu 40.000 euros pour la recherche… grâce aux jeux vidéo », sur tempsreel.nouvelobs.com, (consulté le ).
- Les Nuits de Crohn
- Odile Longueval, « Maladie de Crohn - "C’est une maladie honteuse, il faut changer ça" : une Picarde se bat pour briser les tabous », France 3 Hauts-de-France, (lire en ligne, consulté le ).
- (en) Waddell LA, Rajić A, Sargeant J, Harris J, Amezcua R, Downey L, McEwen SA, et al. « The zoonotic potential of Mycobacterium avium spp. paratuberculosis: a systematic review » Can J Public Health. 2008;99(2). (résumé)
- R. Caruso R & al. (2019) Inflammatory bowel disease ; A specific gene-microbe interaction drives the development of Crohn’s disease–like colitis in mice|Science Immunology 19 avril 2019| Vol. 4, Issue 34, eaaw4341 DOI: 10.1126/sciimmunol.aaw4341
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
- Syndrome de l'intestin irritable
- Rectocolite hémorragique
- Laxophobie
- Maladie inflammatoire chronique de l'intestin (MICI)
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Association François-Aupetit (AFA)
- Fiche d'information sur la Maladie de Crohn sur Orphanet
- Recommandation HAS sur la prise en charge de la maladie de Crohn

