Maladie de Bouveret
| Spécialité | Cardiologie |
|---|
| CIM-10 | I47.1 |
|---|---|
| CIM-9 | 427.89 |
| eMedicine | 898876 |
La maladie de Bouveret, encore appelée « tachycardie jonctionnelle » ou « tachycardie supraventriculaire paroxystique », «tachycardie jonctionnelle par réentrée intra-nodale» [1] correspond à des crises de tachycardie (accélération du rythme cardiaque), se manifestant par des palpitations à débuts et à fins brusques et dont le mécanisme est bien individualisé. Son nom est donné en l'honneur de Léon Bouveret (1850-1929), médecin français qui en a fait la description.
C'est un syndrome clinique décrit avant la découverte de l'électrocardiogramme. L'électrocardiographie puis l'avènement des explorations électrophysiologiques ne décriront que bien plus tard le mécanisme et les différents substrats anatomophysiologiques responsables des crises.
Cette maladie est décrite sur l'ECG comme une tachycardie supraventriculaire par rythme réciproque (formation d'une boucle autoentretenue) le plus souvent soit au niveau du nœud atrioventriculaire, soit à cause de la présence d'un faisceau accessoire mettant en contact les atria avec les ventricules (faisceau de Kent) dans le cadre d'un syndrome de Wolff-Parkinson-White.
Une fibrillation atriale ou un flutter atrial peuvent entraîner des crises de tachycardie qui sont différentes de celles d'un Bouveret mais dont la distinction n'est pas toujours évidente sur l'électrocardiogramme en l'absence de ralentissement.
Physiopathologie[modifier | modifier le code]
Deux mécanismes sont individualisés :
- par réentrée intranodale (plus de la moitié des cas[2]) ;
- par présence d'une voie accessoire (syndrome de Wolff-Parkinson-White, environ un tiers des cas[2]).
Plus rarement, il s'agit d'une tachycardie atriale.
La réentrée intranodale est majoritaire chez la femme et le Wolff-Parkinson-White chez l'homme[3].
Les tachycardies par réentrée intranodale peuvent avoir une participation génétique[4].
Contraction cardiaque normale[modifier | modifier le code]
La contraction cardiaque normale provient d'une dépolarisation (inversion de la polarité électrique de la membrane cellulaire) cyclique d'un groupe de cellules situées sur la partie haute de l'oreillette droite, le nœud sinusal. Cette dépolarisation se propage à l'ensemble du cœur dans un seul sens, imposé par la présence de voies de conduction, et entraîne, au niveau des cellules musculaires, une contraction de ces dernières. Elle est suivie par une « période réfractaire », bref moment où les cellules ne sont plus stimulables.
Maladie de Bouveret par réentrée intranodale[modifier | modifier le code]
Il arrive que dans le nœud atrioventriculaire, la présence de deux voies de conduction parallèles (A et B) coexiste. Ces deux voies de conduction intranodale ont des périodes réfractaires (PR) et des vitesses de conduction différentes. En règle générale, la conduction des oreillettes vers les ventricules se fait par ces deux voies sans problème et sans modification de l'électrocardiogramme.
Si une extrasystole atriale survient alors qu'une des deux voies est perméable (A par exemple) et l'autre en période réfractaire (B), l'influx atrial est conduit vers les ventricules à travers la voie A. Cependant, le temps qu'il descende à travers A, il se peut que la voie B soit sortie de sa période réfractaire. L'influx est alors propagé simultanément vers les ventricules (comme une dépolarisation normale) mais remonte à travers B. Arrivé au pôle supérieur du nœud AV, l'influx redescend à travers A, etc. Le circuit est bouclé et constitue un circuit de réentrée dit dans ce cas « intranodal ».
On peut donc observer sur l'ECG :
- des QRS fins (car conduits par les voies normales à partir du nœud atrioventriculaire) ;
- rapides (car le circuit de réentrée met peu de temps à se boucler) ;
- des ondes P rétrogrades car conduites dans les atria à partir du nœud atrioventriculaire. ces ondes P sont peu visibles car elles sont le plus souvent simultanées aux QRS ou surviennent peu après ce dernier, ce qui les rendent difficilement individualisable.
Maladie de Bouveret sur syndrome de Wolf-Parkinson-White préexistant[modifier | modifier le code]
Le mécanisme de ces crises est plus simple. Elles nécessitent un substrat anatomique particulier constitué par un faisceau accessoire (appelé faisceau de Kent) réalisant un pont électrique entre atria et ventricules (normalement parfaitement isolés par l'anneau fibreux du cœur). Ce pont dépolarise lors des cycles normaux la partie du ventricule sous-jacente avec une légère avance par rapport au reste de la masse ventriculaire, donnant l'aspect d'onde delta à l'ECG de repos. Notons que cette voie accessoire a généralement une période réfractaire plus longue que le nœud AV.
Lorsqu'une extrasystole atriale survient après un temps supérieur à la période réfractaire du nœud atrioventriculaire mais inférieur à la période réfractaire du faisceau accessoire, cette extra systole est conduite dans le nœud sans l'être par le faisceau. Les ventricules sont donc dépolarisés comme si le faisceau n'avait pas fonctionné : le QRS n'est pas empâté car l'onde delta a disparu. Mais lorsque la dépolarisation ventriculaire arrive au niveau du faisceau de Kent, elle s'y propage à contresens vers l'atria sus-jacent.
Le circuit de réentrée est ici constitué après l'extrasystole atriale par :
- le nœud AV,
- les ventricules,
- le faisceau accessoire,
- l'atrium sus-jacent au faisceau,
avec propagation vers le nœud AV pour boucler le circuit.
L'aspect ECG est quasi identique à celui de la maladie de Bouveret par réentrée intranodale, la seule différence marquante est que les ondes P rétrogrades sont plus visibles car sensiblement plus tardives que pour une réentrée intranodale
Particularités[modifier | modifier le code]
La fréquence cardiaque de la tachycardie est limitée par les propriétés électrophysiologiques du nœud atrioventriculaire et de celle de la voie accessoire. En pratique, sans médicaments, cette fréquence est proche de 150 battements par minute et peut aller jusqu'à 240 battements par minute. Cette tachycardie est régulière, à début et à fin brusque. Typiquement, les complexes sont fins.
L'arrêt de la tachycardie est dû à une rupture fonctionnelle de la boucle, l'une de ses parties passant en période réfractaire pour diverses raisons. L'arrêt est donc toujours brutal. Cette rupture peut être produite artificiellement par des manœuvres inhibant le nœud atrioventriculaire (« manœuvres vagales »), par des médicaments agissant de même, ou par une stimulation électrique de l'oreillette, permettant une mise en période réfractaire artificielle.
Il n'a été décrit ici que des maladies de Bouveret initiées par une extrasystole atriale. Les mêmes mécanismes sont applicables dans le cas d'une extrasystole ventriculaire.
Clinique[modifier | modifier le code]
Elle se manifeste typiquement par des accès de palpitations régulières très rapides, sans facteur déclenchant, avec un début et une fin brusque, associés à une sensation de « déclic » intrathoracique. Les premières crises surviennent le plus souvent chez l'adulte. Elles sont plus précoces en cas de tachycardie sur syndrome de Wolff-Parkinson-White[5]. Elles peuvent survenir dès l'enfance voire la toute petite enfance (moins de trois ans).
Les tachycardies par réentrée intranodale sont plus fréquente chez la femme[6]. les crises sont plus fréquentes durant la grossesse[7]. Elles peuvent s'accompagner d'une sensation d'« hyperpulsatilité du cou » en cas de réentrée, sans doute en raison de la contraction atriale survenant sur une valve mitrale et tricuspide fermée[8]. La fréquence des crises est très variable et il peut exister des intervalles libres très prolongés[9].
Après la crise, elle s'accompagne souvent d'une augmentation transitoire de la production d'urine (polyurie post-critique), liée à la libération d'ANP.
La tachycardie peut s'accompagner, dans certains cas, de douleur thoracique, de malaise ou d'angoisses. Il peut exister des symptômes plus atypiques, de type digestif ou neurologique[10].
Elle peut parfois être totalement asymptomatique, découverte lors d'un enregistrement électrocardiographique de longue durée.
La fréquence de ces crises est extrêmement variable, allant d'un épisode isolé à de multiples crises pouvant être invalidantes.
Examens complémentaires[modifier | modifier le code]
Électrocardiogramme[modifier | modifier le code]
Pendant les crises[modifier | modifier le code]
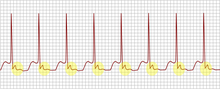

L'électrocardiogramme retrouve une tachycardie régulière à fréquence cardiaque rapide (en général aux alentours de 150 pulsations par minute pouvant parfois atteindre jusqu'à 240). Les complexes ventriculaires (QRS) sont fins (durée < 0,10 s). Ils peuvent être élargis (durée > 0,12 s) en cas de bloc de branche associé (qu'il soit organique ou fonctionnel).
Il y a autant d'ondes P (activation électrique des oreillettes) que de complexes QRS. Ces ondes P sont souvent difficilement visualisables lorsqu'elles sont contemporaines du QRS. Il s'agit dans ce cas, le plus souvent, d'une réentrée intranodale. Si les ondes P sont visibles entre deux QRS, il s'agit alors probablement d'un syndrome de Wolff-Parkinson-White. Dans tous les cas, ces ondes P sont déformées car l'activation des oreillettes se fait de manière ascendante à l'inverse de la situation normale : elles sont dites « rétrogrades ».
Le diagnostic est confirmé par le mode d'arrêt brutal de la tachycardie lors d'une manœuvre vagale, ou, en milieu médicalisé, lors de l'injection d'adénosine triphosphate (ATP).
Sur un ECG de crise, il est parfois difficile de faire la différence entre Bouveret par réentrée intranodale et Bouveret sur syndrome de Wolff-Parkinson-White.
En dehors des crises[modifier | modifier le code]
L'ECG est le plus souvent normal (la crise était due à une réentrée intranodale) ou peut montrer un aspect dit de préexcitation ventriculaire (syndrome de Wolff-Parkinson-White : espace PR court, onde Delta causant un élargissement des complexes QRS et modification du segment ST. L'ECG peut être également normal en cas de Wolff-Parkinson-White.
Le holter (enregistrement de l'ECG sur 24 heures) permet parfois de visualiser le début et l'arrêt d'une crise.
Les montres connectées ont une sensibilité médiocre pour dépister une crise de courte durée[11].
Exploration électrophysiologique[modifier | modifier le code]
L'exploration électrophysiologique consiste à enregistrer directement l'activité électrique du cœur en y positionnant différentes sondes dans ses cavités. Elle n'est nécessaire que dans les formes dont le diagnostic reste douteux. Elle permet de déclencher la tachycardie à l'aide d'une extrasystole atriale. Dans le cas d'une réentrée intranodale, elle permet de prouver la double voie de conduction et de détruire l'une d'elles (la voie lente préférentiellement) par radiofréquence. Dans le cas d'une voie accessoire, elle permet de la localiser d'en préciser les propriétés et de détruire cette dernière, également par radiofréquence.
Causes[modifier | modifier le code]
Elle survient en général chez des sujets jeunes en apparence indemnes de toute maladie cardiaque, mais peut également être favorisée par une hyperthyroïdie, une valvulopathie, un syndrome de Wolff-Parkinson-White.
Traitement[modifier | modifier le code]
La prise en charge des tachycardies atriales a fait l'objet de la publication de recommandations. Les recommandations américaines datent de 2015[12] ; les européennes datent de 2019[13].
La prise en charge consiste tout d'abord à traiter la crise : on parle de réduction. La prévention des récidives (c'est-à-dire la survenue de nouveaux épisodes identiques) vient dans un second temps.
Réduction de la tachycardie[modifier | modifier le code]
En cas de crise bien tolérée, on peut parfois attendre la fin spontanée de la crise.
La réduction de la crise peut être faite par la réalisation, en première intention, de manœuvres vagales[2] destinées à inhiber le nœud atrioventriculaire :
- manœuvre de Valsalva, ou sa forme modifiée (expiration contre obstacle pendant 15 secondes en position semi-assise puis relever les jambes pendant 15 secondes, puis se remettre en position semi assise) qui permet une augmentation du taux de réduction[14],
- déglutition rapide d'un verre d'eau froide,
- efforts de vomissements,
- immersion de la face dans l'eau,
- compression forte des globes oculaires (à éviter si on ne connaît pas la manœuvre),
- massage sino-carotidien unilatéral avec une efficacité équivalente aux manœuvres vagales[15] (contre-indications : antécédents d'accident vasculaire cérébral, de sténose carotidienne (existence d'un souffle carotidien)).
Il est également possible de réaliser une réduction par médicament :
- en première intention : adénosine triphosphate[16] en intraveineuse rapide. Ce dernier, déprimant fortement et transitoirement la conduction atrioventriculaire, permet de faire le diagnostic de ce type de tachycardie s'il parvient à régulariser le cœur. Elle doit être administrée sous surveillance électrocardiographique.
- en deuxième intention : inhibiteur calcique bradycardisant de type vérapamil ou diltiazem qui peuvent être donné par voie orale[17],
- D'autres antiarythmiques sont utilisables : flécaïnide, amiodarone, digitaliques,
- exceptionnellement, réduction par choc électrique externe.
Prévention des récidives[modifier | modifier le code]
Les crises ne sont pas, en règle générale, dangereuses, même si elles peuvent générer gène et anxiété. En cas d'accès de tachycardie bien tolérés, rares et facilement réduits par le patient lui-même, aucun traitement n'est nécessaire.
En cas d'accès fréquents avec crises prolongées, invalidantes, difficilement réduites par le patient lui-même, une ablation par radiofréquence (au cours d'une exploration électrophysiologique) est proposée. le taux de succès dépasse les 95% avec un taux faible de survenue d'un bloc atrio-ventriculaire[13].
Un traitement par antiarythmiques, bêta-bloquants, inhibiteurs calciques bradycardisants peut être proposé en troisième intention. L'utilisation de l'amiodarone reste exceptionnelle.
Le syndrome de Wolff-Parkinson-White pose des problèmes spécifiques nécessitant parfois un traitement plus agressif.
Notes et références[modifier | modifier le code]
- Claude Kouakam, « Une tachycardie, un démarrage… une solution ! », La Presse Médicale Formation, vol. 1, no 4, , p. 428–431 (ISSN 2666-4798, DOI 10.1016/j.lpmfor.2020.09.002, lire en ligne, consulté le )
- Peng G, Zei PC, Diagnosis and Management of Paroxysmal Supraventricular Tachycardia, JAMA, 2024;331:601–610
- Porter MJ, Morton JB, Denman R et al. Influence of age and gender on the mechanism of supraventricular tachycardia, Heart Rhythm, 2004;1:393-6
- Michowitz Y, Anis-Heusler A, Reinstein E, Tovia-Brodie O, Glick A, Belhassen B, Familial Occurrence of Atrioventricular Nodal Reentrant Tachycardia, Circ Arrhythm Electrophysiol, 2017;10:e004680
- Goyal R, Zivin A, Souza J et al. Comparison of the ages of tachycardia onset in patients with atrioventricular nodal reentrant tachycardia and accessory pathway-mediated tachycardia, Am Heart J, 1996;132:765–7
- Porter MJ, Morton JB, Denman R et al. Influence of age and gender on the mechanism of supraventricular tachycardia, Heart Rhythm, 2004;1:393–6
- Lee SH, Chen SA, Wu TJ et al. Effects of pregnancy on first onset and symptoms of paroxysmal supraventricular tachycardia, Am J Cardiol, 1995;76:675–8
- Laurent G, Leong-Poi H, Mangat I et al. Influence of ventriculoatrial timing on hemodynamics and symptoms during supraventricular tachycardia, J Cardiovasc Electrophysiol, 2009;20:176–81
- D'Este D, Zoppo F, Bertaglia E et al. Long-term outcome of patients with atrioventricular node reentrant tachycardia, Int J Cardiol, 2007;115:350-3
- Yetkin E, Ozturk S, Cuglan B, Turha H, Clinical presentation of paroxysmal supraventricular tachycardia: evaluation of usual and unusual symptoms, Cardiovasc Endocrinol Metab, 2020;9:153-158
- Sequeira N, D’Souza D, Angaran P, Aves T, Dorian P, Common wearable devices demonstrate variable accuracy in measuring heart rate during supraventricular tachycardia'', Heart Rhythm, 2020;17:854-859
- Page RL, Joglar JA, Caldwell MA et al. 2015 ACC/AHA/HRS Guideline for the Management of Adult Patients With Supraventricular Tachycardia: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society, Circulation, 2016;133:e506-e574
- Brugada J, Katritsis DG, Arbelo et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardia The Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC): Developed in collaboration with the Association for European Paediatric and Congenital Cardiology (AEPC), Eur Heart J, 2020;41:655-720
- Appelboam A, Reuben A, Mann C et al. Postural modification to the standard Valsalva manoeuvre for emergency treatment of supraventricular tachycardias (REVERT): a randomised controlled trial, Lancet, 2015;386:1747-1753
- Lim SH, Anantharaman V, Teo WS, Goh PP, Tan AT. Comparison of treatment of supraventricular tachycardia by Valsalva maneuver and carotid sinus massage, Ann Emerg Med, 1998;31:30-35
- Layland J, Carrick D, Lee M, Oldroyd K, Berry C. Adenosine: physiology, pharmacology, and clinical applications, JACC Cardiovasc Interv, 2014;7:581-591
- Alboni P, Tomasi C, Menozzi C et al. Efficacy and safety of out-of-hospital self-administered single-dose oral drug treatment in the management of infrequent, well-tolerated paroxysmal supraventricular tachycardia, J Am Coll Cardiol, 2001;37:548-53

