Magnésocène
| Magnésocène | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | magnésocène | ||
| Synonymes |
bis(η5-cyclopentadiényl)magnésium(II) |
||
| No CAS | |||
| No ECHA | 100.110.799 | ||
| PubChem | 21944238 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide cristallin incolore[1] ou blanc[2] | ||
| Propriétés chimiques | |||
| Formule | C10H10Mg |
||
| Masse molaire[3] | 154,491 4 ± 0,009 3 g/mol C 77,74 %, H 6,52 %, Mg 15,73 %, |
||
| Propriétés physiques | |||
| T° fusion | 176 °C[4]/180 °C (déomposition)[2] | ||
| T° ébullition | 290 °C[4] | ||
| Paramètre de solubilité δ | se décompose au contact de l'eau[2] | ||
| T° d'auto-inflammation | pyrophorique (catégorie 1)[2] | ||
| Point d’éclair | 21 °C[2] | ||
| Pression de vapeur saturante | 0,05 hPa (25 °C) 1,00 hPa (60 °C)[2] |
||
| Précautions | |||
| SGH | |||
| H228, H250, H252, H261, H314, H319, H335, P210, P222, P280, P231+P232, P305+P351+P338 et P422 |
|||
| NFPA 704[2] | |||
| Directive 67/548/EEC[2] | |||
| Transport[4] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
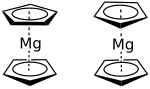
Le magnésocène ou bis(η5-cyclopentadiényl)magnésium(II) est un composé organomagnésien de la famille des métallocènes, de formule Mg(C5H5)2, parfois abrégée Mg(Cp)2.
Structure et propriétés[modifier | modifier le code]
Bien que le magnésium soit un métal alcalino-terreux, le magnésocène adopte la structure sandwich classique des métallocènes : l'atome central métallique, ici le magnésium, se retrouve à l'état d'oxydation +II et se trouve pris en sandwich entre deux cycles de cyclopentadiène parallèles, formant des liaisons haptiques Mg-C. E. Weiß a montré que le magnésocène sous forme cristalline adopte une conformation décalée, où les longueurs des liaisons Mg-C sont de 230 pm ; en revanche, en phase gazeuse, A. Haland a montré que ces liaisons se détendaient et que le complexe adoptait alors une conformation éclipsée[5],[1]. La nature de ces liaisons, ionique ou covalente, n'est à ce jour pas certaine. La structure sandwich, analogue à celle du ferrocène peut laisser penser que ces liaisons sont covalentes, mais il n'est pas non plus exclu qu'elle résulte de forces de van der Waals. Les indices tendant à prouver un caractère ionique de la liaison sont une forte conductivité électrique dans l'ammoniaque, la vigoureuse réaction d'hydrolyse du complexe ainsi qu'un déplacement de 108 ppm en RMN du carbone 13 (à comparer avec un déplacement de 103,6 ppm pour LiCp, 103,4 ppm pour NaCp et 68,2 ppm pour FeCp2)[6]. En revanche, les données par RMN du magnésium 25 suggèrent plutôt une nature covalente[5].
Le magnésocène se présente sous la forme d'un solide blanc à incolore, dont la poudre se sublime à 50 °C/1×10-3 mbar. Il s'enflamme spontanément au contact de l'air et explose au contact de l'eau[1],[2].
Comme ses analogues plus lourds, le magnésocène se lie facilement avec le dioxygène, le diazote, les composés phosphorés et les bases de Lewis avec lesquels il forme des adduits. Il forme également avec l'ammoniac et les amines des complexes 1:1 ou 1:2. Grâce à de tels complexes avec les amines primaires ou secondaires, il peut être isolé et étudié par cristallographie aux rayons X. Dans ces adduits, l'hapticité des ligands Cp varie de η5 à η2[7]. Avec le THF il forme des complexes η5,η1[7].
Spectroscopie[modifier | modifier le code]
En spectroscopie infrarouge, le magnésocène présente des bandes à 2 926 cm−1 (élongation de C-H aromatique), 1 630 cm−1 (vibration du cycle aromatique) et 770 cm−1 (déformation de C-Hg). Le spectre de RMNH présente un singulet à 6,00 ppm, la RMN du carbone 13 un singulet à 107,8 ppm[1].
Synthèse[modifier | modifier le code]
Le magnésocène fut synthétisé pour la première fois en 1954 de façon indépendante par E. O. Fischer[8] et G. Wilkinson[9].
Le magnésocène peut être synthétisé par dismutation du bromure de cyclopentadiénylmagnésium (CpMgBr). Dans un premier temps, CpMgBr est obtenu par réaction entre le bromure d'éthylmagnésium (C2H6MgBr) et le cyclopentadiène (Cp), qui est ensuite dismuté à 220 °C et 1×10−4 mbar en magnésocène et bromure de magnésium (MgBr2)[5] :
- Et2O = éther diéthylique
Un autre voie possible est la réaction entre le magnésium métallique et le cyclopentadiène à 500 °C :
En laboratoire, il est aussi possible de synthétiser le magnésocène par réaction entre un diorganylmagnésium et le cyclopentadiène[1] :
Utilisation[modifier | modifier le code]
Du fait de sa faible stabilité, le magnésocène sert surtout à transférer des cycles de cyclopentadiène, par exemple vers d'autres métaux pour former d'autres métallocènes, tout en formant un halogénure de magnésium stable[5] :
Le magnésocène et ses adduits sont aussi des sources en matériau sublimable pour des techniques de dépôt chimique en phase vapeur (CVD), notamment la MOCVD, permettant par exemple de produire des LED vertes ou bleues[1].
Notes et références[modifier | modifier le code]
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Magnesocen » (voir la liste des auteurs).
- (de) Anja Jaenschke, Basenaddukte des Magnesocens: Darstellung und Strukturuntersuchung von Cyclopentadienyl-, Pentamethylcyclopentadienyl- und Indenyl-Metallocenen des Magnesiums (thèse de doctorat), université de Hambourg, (lire en ligne)
- Fiche Sigma-Aldrich du composé Bis(cyclopentadienyl)magnesium(II), consultée le 24 novembre 2014.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Bis(cyclopentadienyl)magnesium », sur Alfa Aesar (consulté le ).
- Christoph Elschenbroich, Organometallchemie, B. G. Teubner Verlag, , 65–71 p. (ISBN 978-3-8351-0167-8)
- (de) Erwin Riedel, Moderne Anorganische Chemie, de Gruyter, (ISBN 978-3-11-019060-1), p. 623
- Zvi Rappoport, Ilan Marek, The Chemistry of Organomagnesium Compounds, Band 2., John Wiley & Sons, , 122-129 p. (ISBN 978-0-470-05719-3)
- E. O. Fischer, W. Hafner, « Cyclopentadienyl-vanadin-tetracarbonyl », Zeitschrift für Naturforschung B - A Journal of Chemical Sciences, , p. 503-504 (lire en ligne)
- G. Wilkenson, F.A. Cotton, Chem. Ind.(London) 1954, 307-308







![{\displaystyle \mathrm {Mg(C_{2}H_{5})Br\ {\xrightarrow[{-C_{2}H_{6}}]{+C_{5}H_{6},\ Et_{2}O}}\ Mg(C_{5}H_{5})Br{\xrightarrow[{-MgBr_{2}}]{x2,\ 220^{\circ }C,\ 10^{4}mbar}}\ Mg(C_{5}H_{5})_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ed7f18c823ccda3506d0be3370c676d0620bcc1)
![{\displaystyle \mathrm {Mg\ +\ 2\ C_{5}H_{6}\ {\xrightarrow[{-H_{2}}]{500^{\circ }C}}\ Mg(C_{5}H_{5})_{2}\ } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8141c8b60089ae5deb21103d070343b250162168)

