Chimie des nanotubes de carbone

La chimie des nanotubes de carbone implique des réactions chimiques qui sont utilisées pour modifier les propriétés de nanotubes de carbone. Ces derniers peuvent être fonctionnalisés pour obtenir des propriétés particulières, leur donnant un large éventail d'applications. Les deux méthodes principales de fonctionnalisation des nanotubes sont les modifications covalentes et non-covalentes[1].
À cause de leur nature hydrophobique, les nanotubes tendent à s'agglomérer, gênant leur dispersion dans des solvants. Les agrégats de nanotubes réduisent les performances mécaniques du composite final. La surface des nanotubes peut ainsi être modifiée pour réduire leur hydrophobicité et augmenter l'adhésion par liaison chimique aux interfaces avec un polymère.
Modifications covalentes[modifier | modifier le code]

Une modification covalente lie un groupe fonctionnel sur le nanotube de carbone. Des groupes fonctionnels peuvent être liés sur la paroi latérale ou aux extrémités d'un nanotube[1], les extrémités ayant la plus haute réactivité. Bien que les modifications covalentes sont très stables, le processus de liaison perturbe l'hybridation sp2 des atomes de carbone à cause de la formation d'une liaison σ[1].
Oxydation[modifier | modifier le code]
La purification et l'oxydation des nanotubes de carbone sont bien représentées dans la littérature[2],[3],[4],[5]. Ces procédés sont essentiels pour la production à faible rendement de nanotubes où les particules de carbone, les particules de carbone amorphe et d'autres résidus, forment une part significative du matériau global et sont également importants pour l'introduction de groupes fonctionnels de surface[6]. Lors d'une oxydation acide, le réseau de liaisons carbone-carbone des couches graphitiques est rompu, permettant l'introduction d'unités d'oxygène sous les formes des groupes carboxyle, phénol et lactone[7], qui ont été largement exploités pour des fonctionnalisations chimiques plus poussées[8].
Les premières études sur l'oxydation des nanotubes de carbone concernent des réactions en phase gazeuse avec des vapeurs d'acide nitrique dans de l'air, qui fonctionnalisent sans distinction les nanotubes avec des groupes carboxyle, carbonyle ou hydroxyle[9]. Dans des réactions en phase liquide, les nanotubes sont traités avec des solutions oxydantes d'acide nitrique ou une combinaison d'acides nitrique et sulfurique avec les mêmes effets[10]. Cependant, une suroxydation pouvait survenir, provoquant la rupture du nanotube en fragments, connus sous le nom de fragments carbonés[11]. Xing et al. ont utilisé une oxydation aux acides nitrique et sulfurique assistée par sonication de nanotubes pour produire des groupes carboxyle et carbonyle[12]. Après la réaction d'oxydation dans une solution acide, un traitement au peroxyde d'hydrogène limite les dommages sur le réseau du nanotube de carbone[13]. Les nanotubes de carbone mono-feuillets peuvent être raccourcis de manière modulable avec de l'oléum et de l'acide nitrique. L'acide nitrique coupe les nanotubes de carbone tandis que l'oléum crée un canal[1].
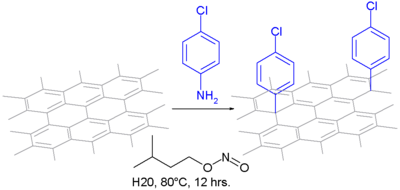
Dans un type de modification, l'aniline est oxydée en un intermédiaire diazonium. Après rejet de l'azote, il forme une liaison covalente en tant que radical aryle (en)[14] :
Estérification, amidation[modifier | modifier le code]
Les groupes carboxyles sont utilisés comme précurseurs pour la plupart des réactions d'estérification et d'amidation. Le groupe carboxyle est converti en un chlorure d'acyle avec l'utilisation d'un chlorure de thionyle ou d'oxalyle qui réagit ensuite avec l'amide, l'amine ou l'alcool désiré[1]. Les réactions d'amination peuvent faciliter le dépôt des nanotubes de carbone sur des nanoparticules d'argent. Les nanotubes de carbone fonctionnalisés avec des amides chélatent les nanoparticules d'argent. Les nanotubes de carbone modifiés avec des chlorures d'acyle réagissent facilement avec les molécules hautement ramifiées tels les poly(amidoamine) (en)[15]. Les nanotubes modifiés avec des amines peuvent être préparés par réaction entre l'éthylènediamine et des nanotubes de carbone porteur de chlorures d'acyle[16].
Halogénation[modifier | modifier le code]
Les nanotubes de carbone peuvent réagir avec l'acide peroxytrifluroacétique, donnant principalement des groupes fonctionnels acide carboxylique trifluoroacétique[1]. Les nanotubes de carbone fluorés, via substitution, peuvent ensuite être à nouveau fonctionnalisés à partir de l'urée, de la guanidine, du thiocarbamide et d'aminosilanes[17]. Utilisant la réaction de Hunsdiecker, les nanotubes traités à l'acide nitrique peuvent réagir avec le diacétate d'iodosobenzène pour donner des nanotubes de carbone porteurs d'iode[18].
Cycloaddition[modifier | modifier le code]
Des protocoles de cycloadditions existent également pour les nanotubes de carbone comme des réactions de Diels-Alder, des cycloadditions 1,3-dipolaire d'ylures d'azométhines (en) et des réactions de cycloadditions azoture–alcène[19]. Un exemple est une réaction de Diels-Alder assistée par l'hexacarbonyle de chrome et de fortes pressions[20].
La réaction de cycloaddition 1,3-dipolaire la plus connue implique des ylures d'azométhine et des nanotubes de carbone. L'addition d'un cycle pyrrolidine peut conduire à divers groupes fonctionnels comme des dendrimères de poly(amidoamine)s de seconde génération[21], des groupes phthalocyanines[22], des groupes perfluoroalkylsilane[23] et des groupes amino-éthylèneglycol[24]. La réaction de Diels-Alder est notamment utilisée sur des nanotubes fluorés. Une telle réaction avec des nanotubes fluorés peut avoir lieu avec des diènes comme le 2,3-diméthyl-1,3-butadiène, l'anthracène et le 2-triméthylsiloxyl-1,3-butadiène[16].
Addition radicalaire[modifier | modifier le code]

La modification de nanotubes de carbone par des sels d'aryle de diazonium a été étudiée par Tour et al.[26]. À cause de la difficulté de la production in situ de composés diazonium, d'autres méthodes ont été explorées. Stephenson et al. ont ainsi utilisé des dérivés de l'aniline avec du nitrite de sodium, de l'acide sulfurique à 96 % et du persulfate d'ammonium[27]. Les nanotubes de carbone fonctionnalisés par le diazonium sont utilisés comme précurseurs pour des modifications plus complexes. Des réactions de couplage de Suzuki et de Heck ont été réalisées à partir de nanotubes fonctionnalisés par des groupements iodophényle[28].
Addition nucléophile[modifier | modifier le code]
Hirsch et al. ont réalisé des additions nucléophiles par réaction entre des organolithiens et des organomagnésiens sur des nanotubes de carbone. Une oxydation dans l'air successive à cette réaction permet de créer des nanotubes de carbone modifiés par des groupes alkyles[29]. Hirsch et al. ont également réalisé des additions nucléophiles de groupes amine par l'action de l'amidure de lithium, conduisant à des nanotubes de carbone modifiés avec des groupes amine[30].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carbon nanotube chemistry » (voir la liste des auteurs).
- (en) Nikolaos Karousis, Nikos Tagmatarchis et Dimitrios Tasis, « Current Progress on the Chemical Modification of Carbon Nanotubes », Chemical Reviews, vol. 110, no 9, , p. 5366–5397 (PMID 20545303, DOI 10.1021/cr100018g).
- (en) S. C. Tsang, P. J. F. Harris et M. L. H. Green, « Thinning and opening of carbon nanotubes by oxidation using carbon dioxide », Nature, vol. 362, no 6420, , p. 520–522 (DOI 10.1038/362520a0).
- (en) P. M. Ajayan, T. W. Ebbesen, T. Ichihashi, S. Iijima, K. Tanigaki et H. Hiura, « Opening carbon nanotubes with oxygen and implications for filling », Nature, vol. 362, no 6420, , p. 522–525 (DOI 10.1038/362522a0).
- (en) S. C. Tsang, Y. K. Chen, P. J. F. Harris et M. L. H. Green, « A simple chemical method of opening and filling carbon nanotubes », Nature, vol. 372, no 6502, , p. 159–162 (DOI 10.1038/372159a0).
- (en) Hidefumi Hiura, Thomas W. Ebbesen et Katsumi Tanigaki, « Opening and purification of carbon nanotubes in high yields », Advanced Materials, vol. 7, no 3, , p. 275–276 (DOI 10.1002/adma.19950070304).
- (en) K Esumi, M. Ishigami, A. Nakajima, K. Sawada et H. Honda, « Chemical treatment of carbon nanotubes », Carbon, vol. 34, no 2, , p. 279–281 (DOI 10.1016/0008-6223(96)83349-5).
- (en) M Shaffer, X. Fan et A.H. Windle, « Dispersion and packing of carbon nanotubes », Carbon, vol. 36, no 11, , p. 1603–1612 (DOI 10.1016/S0008-6223(98)00130-4).
- (en) Ya-Ping Sun, Kefu Fu, Yi Lin et Weijie Huang, « Functionalized Carbon Nanotubes: Properties and Applications », Accounts of Chemical Research, vol. 35, no 12, , p. 1096–104 (PMID 12484798, DOI 10.1021/ar010160v).
- (en) Wei Xia, Chen Jin, Shankhamala Kundu et Martin Muhler, « A highly efficient gas-phase route for the oxygen functionalization of carbon nanotubes based on nitric acid vapor », Carbon, vol. 47, no 3, , p. 919–922 (DOI 10.1016/j.carbon.2008.12.026).
- (en) V. Datsyuk, M. Kalyva, K. Papagelis, J. Parthenios, D. Tasis, A. Siokou, I. Kallitsis et C. Galiotis, « Chemical oxidation of multiwalled carbon nanotubes », Carbon, vol. 46, no 6, , p. 833–840 (DOI 10.1016/j.carbon.2008.02.012).
- (en) Céline Bergeret, Jack Cousseau, Vincent Fernandez, Jean-Yves Mevellec et Serge Lefrant, « Spectroscopic Evidence of Carbon Nanotubes’ Metallic Character Loss Induced by Covalent Functionalization via Nitric Acid Purification », The Journal of Physical Chemistry C, vol. 112, no 42, , p. 16411–16416 (DOI 10.1021/jp806602t).
- (en) Yangchuan Xing, Liang Li, Charles C. Chusuei et Robert V. Hull, « Sonochemical Oxidation of Multiwalled Carbon Nanotubes », Langmuir, vol. 21, no 9, , p. 4185–4190 (DOI 10.1021/la047268e).
- (en) F. Avilés, J. V. Cauich-Rodríguez, L. Moo-Tah, A. May-Pat et R. Vargas-Coronado, « Evaluation of mild acid oxidation treatments for MWCNT functionalization », Carbon, vol. 47, no 13, , p. 2970–2975 (DOI 10.1016/j.carbon.2009.06.044).
- (en) B. K. Price et J. M. Tour, « Functionalization of Single-Walled Carbon Nanotubes "On Water" », Journal of the American Chemical Society, vol. 128, no 39, , p. 12899–12904 (PMID 17002385, DOI 10.1021/ja063609u).
- (en) Lei Tao, Gaojian Chen, Giuseppe Mantovani, Steve York et David M. Haddleton, « Modification of multi-wall carbon nanotube surfaces with poly(amidoamine) dendrons: Synthesis and metal templating », Chemical Communications, no 47, , p. 4949 (DOI 10.1039/B609065F).
- (en) J. S. Jeong, S. Y. Jeon, T. Y. Lee, J. H. Park, J. H. Shin, P. S. Alegaonkar, A. S. Berdinsky et J. B. Yoo, « Fabrication of MWNTs/nylon conductive composite nanofibers by electrospinning » (Proceedings of the joint 11th International Conference on New Diamond Science and Technology and the 9th Applied Diamond Conference 2006ICNDST-ADC 2006), Diamond and Related Materials, vol. 15, nos 11–12, , p. 1839–1843 (DOI 10.1016/j.diamond.2006.08.026).
- (en) Luca Valentini, Jelena Macan, Ilaria Armentano, Francesco Mengoni et Josè M. Kenny, « Modification of fluorinated single-walled carbon nanotubes with aminosilane molecules », Carbon, vol. 44, no 11, , p. 2196–2201 (DOI 10.1016/j.carbon.2006.03.007).
- (en) Karl S. Coleman, Amit K. Chakraborty, Sam R. Bailey, Jeremy Sloan et Morgan Alexander, « Iodination of Single-Walled Carbon Nanotubes », Chemistry of Materials, vol. 19, no 5, , p. 1076–1081 (DOI 10.1021/cm062730x).
- (en) I. Kumar, S. Rana et J. W. Cho, « Cycloaddition Reactions: A Controlled Approach for Carbon Nanotube Functionalization », Chemistry: A European Journal, vol. 17, no 40, , p. 11092–11101 (DOI 10.1002/chem.201101260).
- (en) C. C. Ménard-Moyon, F. O. Dumas, E. Doris et C. Mioskowski, « Functionalization of Single-Wall Carbon Nanotubes by Tandem High-Pressure/Cr(CO)6 Activation of Diels−Alder Cycloaddition », Journal of the American Chemical Society, vol. 128, no 46, , p. 14764–14765 (PMID 17105260, DOI 10.1021/ja065698g).
- (en) Stéphane Campidelli, Chloé Sooambar, Enrique Lozano Diz, Christian Ehli, Dirk M. Guldi et Maurizio Prato, « Dendrimer-Functionalized Single-Wall Carbon Nanotubes: Synthesis, Characterization, and Photoinduced Electron Transfer », Journal of the American Chemical Society, vol. 128, no 38, , p. 12544–12552 (PMID 16984205, DOI 10.1021/ja063697i)
- (en) Beatriz Ballesteros, Gema de la Torre, Christian Ehli, G. M. Aminur Rahman, F. Agulló-Rueda, Dirk M. Guldi et Tomás Torres, « Single-Wall Carbon Nanotubes Bearing Covalently Linked Phthalocyanines − Photoinduced Electron Transfer », Journal of the American Chemical Society, vol. 129, no 16, , p. 5061–5068 (PMID 17397152, DOI 10.1021/ja068240n)
- (en) Vasilios Georgakilas, Athanasios B. Bourlinos, Radek Zboril et Christos Trapalis, « Synthesis, Characterization and Aspects of Superhydrophobic Functionalized Carbon Nanotubes », Chemistry of Materials, vol. 20, no 9, , p. 2884–2886 (DOI 10.1021/cm7034079)
- (en) Bruno Fabre, Fanny Hauquier, Cyril Herrier, Giorgia Pastorin, Wei Wu, Alberto Bianco, Maurizio Prato, Philippe Hapiot et Dodzi Zigah, « Covalent Assembly and Micropatterning of Functionalized Multiwalled Carbon Nanotubes to Monolayer-Modified Si(111) Surfaces », Langmuir, vol. 24, no 13, , p. 6595–6602 (DOI 10.1021/la800358w)
- (en) T Umeyama, J Baek, Y Sato, K Suenaga, F Abou-Chahine, NV Tkachenko, H Lemmetyinen et H Imahori, « Molecular interactions on single-walled carbon nanotubes revealed by high-resolution transmission microscopy », Nature Communications, vol. 6, , p. 7732 (PMID 26173983, PMCID 4518305, DOI 10.1038/ncomms8732).
- (en) Hugh Hayden, Yurii K. Gun’ko et Tatiana S. Perova, « Chemical modification of multi-walled carbon nanotubes using a tetrazine derivative », Chemical Physics Letters, vol. 435, nos 1–3, , p. 84–89 (DOI 10.1016/j.cplett.2006.12.035).
- (en) Jason J. Stephenson, Jared L. Hudson, Samina Azad et James M. Tour, « Individualized Single Walled Carbon Nanotubes from Bulk Material Using 96% Sulfuric Acid as Solvent », Chemistry of Materials, vol. 18, no 2, , p. 374–377 (DOI 10.1021/cm052204q).
- (en) Fuyong Cheng, Patigul Imin, Christian Maunders, Gianluigi Botton et Alex Adronov, « Soluble, Discrete Supramolecular Complexes of Single-Walled Carbon Nanotubes with Fluorene-Based Conjugated Polymers », Macromolecules, vol. 41, no 7, , p. 2304–2308 (DOI 10.1021/ma702567y).
- (en) Ralf Graupner, Jürgen Abraham, David Wunderlich, Andrea Vencelová, Peter Lauffer, Jonas Röhrl, Martin Hundhausen, Lothar Ley et Andreas Hirsch, « Nucleophilic−Alkylation−Reoxidation: A Functionalization Sequence for Single-Wall Carbon Nanotubes », Journal of the American Chemical Society, vol. 128, no 20, , p. 6683–6689 (PMID 16704270, DOI 10.1021/ja0607281).
- (en) Zois Syrgiannis, Frank Hauke, Jonas Röhrl, Martin Hundhausen, Ralf Graupner, Yiannis Elemes et Andreas Hirsch, « Covalent Sidewall Functionalization of SWNTs by Nucleophilic Addition of Lithium Amides », European Journal of Organic Chemistry, vol. 2008, no 15, , p. 2544–2550 (DOI 10.1002/ejoc.200800005).
