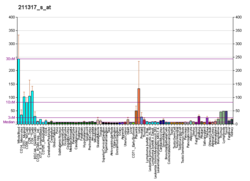
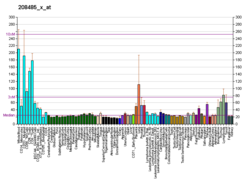
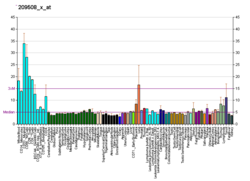
C-FLIP
c-FLIP (de l'anglais : cellular FLICE-like inhibitory protein) est une protéine humaine codée par le gène CFLAR[5],[6] situé sur le chromosome 2 humain. C'est un homologue et le principal inhibiteur des caspases initiatrices 8 et 10 et par conséquent de l'apoptose extrinsèque.
Histoire[modifier | modifier le code]
Cette protéine a de nombreux noms — FLIP ; Casper ; i-FLICE ; MRIT ; FLAME-1 ;CLARP — du fait qu'en 1997, elle ait été découverte simultanément par de nombreuses équipes[5],[6].
Structure[modifier | modifier le code]
c-FLIP est présent sous trois isoformes, une longue (FLIPL, FLIP long) de 55 kDa et deux isoformes courtes (FLIPS et FLIPR, Short et Raji) de respectivement 26 et 24 kDa. Les trois isoformes possèdent à leurs extrémités N-terminale domaines effecteur de mort (en) (DED) nécessaire à leur liaison avec la protéine adaptatrice FADD et leur action sur les caspases. Seule l'isoforme longue (FLIPL) possède un domaine protéase de type caspase (cysteinyl-aspartate-cleaving proteases), mais celui-ci est non fonctionnel car délété de certains acides aminés de son site catalytique[5].
Mode d'action[modifier | modifier le code]
Le mode d'action de c-FLIP n'est pas encore pleinement établi et dépend de l'isoforme en question. Il agit en formant des complexes avec la caspase 8 ou la caspase 10, qui dans le cas des isoformes courtes (FLIPS et FLIPR) inhibent leurs activités, et dans le cas de l'isoforme longue permet une activité tout en limitant les cibles de cette activité[7].
Notes et références[modifier | modifier le code]
- GRCh38: Ensembl release 89: ENSG00000003402 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000026031 - Ensembl, May 2017
- « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- (en) Shu HB, Halpin DR, Goeddel DV, « Casper is a FADD- and caspase-related inducer of apoptosis » Immunity. 1997;6(6):751-63.
- (en) Irmler M, Thome M, Hahne M, Schneider P, Hofmann K, Steiner V, Bodmer JL, Schroter M, Burns K, Mattmann C, Rimoldi D, French LE, Tschopp J, « Inhibition of death receptor signals by cellular FLIP » Nature. 1997;10;388(6638):190-5.
- (en) Feoktistova M, Geserick P, Kellert B, Dimitrova DP, Langlais C, Hupe M, Cain K, MacFarlane M, Häcker G, Leverkus M, « cIAPs block Ripoptosome formation, a RIP1/caspase-8 containing intracellular cell death complex differentially regulated by cFLIP isoforms » Mol Cell. 2011 Aug 5;43(3):449-63. DOI 10.1016/j.molcel.2011.06.011