Acide sulfureux
| Acide sulfureux | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | acide sulfureux sulfite d'hydrogène |
| No CAS | |
| No ECHA | 100.029.066 |
| No CE | 231-973-1 |
| PubChem | 1100 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
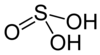
| Formule | H2SO3 |
| Masse molaire[1] | 82,079 ± 0,006 g/mol H 2,46 %, O 58,48 %, S 39,07 %, |
| pKa | 1,81 et 6,99 |
| Propriétés physiques | |
| Solubilité | Miscible à l'eau [2] |
| Masse volumique | 1,03 g·cm-3 (20 °C)[2] |
| Précautions | |
| SGH[3] | |
| H314, H332, P280, P305, P310, P338 et P351 |
|
| SIMDUT[4] | |
 E, |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L’acide sulfureux est un composé chimique de formule H2SO3. S'il a été détecté en phase gazeuse[5], il n'est en revanche pas certain qu'il existe effectivement en solution.
Les bases conjuguées de cet acide sont quant à elles communes : l'anion hydrogénosulfite de formule HSO3- et l'anion sulfite de formule SO32-.
Description
L'acide sulfureux est un acide minéral résultant formellement de la dissolution de dioxyde de soufre SO2 dans de l'eau H2O selon la réaction :
- SO2 (g) + H2O(l) → H2SO3 (aq) : K << 10-9.
Cependant, la molécule H2SO3 solvatée par l'eau n'est pas stable et conduit immédiatement aux ions hydrogénosulfite HSO3- et sulfite SO32- :
- SO2 (g) + 2 H2O(l) H3O+(aq) + HSO3-(aq) : pKa1 = 1,81.
- HSO3-(aq) + H2O(l) H3O+(aq) + SO32-(aq) : pKa2 = 6,99.
Ce type de solution acide est utilisé comme conservateur alimentaire, notamment pour les fruits secs, le vin et la conservation de la viande, ainsi que comme désinfectant, agent réducteur et blanchissant doux, utilisé notamment sur les matériaux qui seraient endommagés par un blanchissage aux produits chlorés.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Sulfurous acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2009 (JavaScript nécessaire)
- SIGMA ALDRICH
- « Acide sulfureux » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- D. Sülzle, M. Verhoeven, J. K. Terlouw, H. Schwarz, "Preparation and characterization of sulfurous acid and its radical cation as stable molecules in the gas phase" Angew. Chem. Int. Edn. Engl. 27, 1533-4 (1988). DOI:10.1002/ange.1988100112



