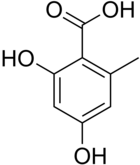
Acide orsellinique
| Acide orsellinique | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide 2,4-dihydroxy-6-méthylbenzoïque | |
| No CAS | ||
| No ECHA | 100.115.964 | |
| PubChem | 68072 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C8H8O4 [Isomères] |
|
| Masse molaire[1] | 168,146 7 ± 0,008 2 g/mol C 57,14 %, H 4,8 %, O 38,06 %, |
|
| Propriétés physiques | ||
| T° fusion | 176 °C[2],[3] | |
| Solubilité | soluble dans l'eau et le diméthylsulfoxyde[4] soluble dans l'éthanol et l'éther[3] |
|
| Précautions | ||
| SGH[4] | ||
| H315, H319, H335, P261, P280, P304+P340, P305+P351+P338, P405 et P501 |
||
| Écotoxicologie | ||
| LogP | 1,550[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'acide orsellinique, plus précisément l'acide ortho-orsellinique ou acide 2,4-dihydroxy-6-méthylbenzoïque est un acide carboxylique de formule C8H8O4 . Il joue un rôle important en chimie organique et en biochimie des lichens du genre Aspergillus ou Penicillium desquels il peut être extrait[5], et chez lesquels la biosynthèse s’effectue par les polycétides.
Structure[modifier | modifier le code]
L'acide orsellinique est constitué d'un cycle benzénique substitué par un groupe carboxyle (acide benzoïque), deux groupes hydroxyle (phénol) aux positions 2 et 4, et d'un groupe méthyle en position 6. Il se rattache aux acides phénoliques, sous-groupe des acides dihydroxybenzoïques et se différencie en pratique de l'acide β-résorcylique (acide 2,4-dihydroxybenzoïque) par substitution d'un groupe méthyle.
Propriétés[modifier | modifier le code]
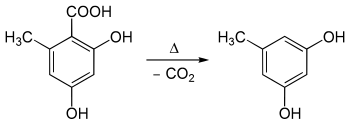
L'acide orsellinique se présente sous la forme de cristaux incolores en forme d'aiguilles[3] qui fondent rapidement et se décomposent vers 175 °C[6], produisant de l'orcinol par décarboxylation[7] :
Occurrence et biosynthèse[modifier | modifier le code]
L'acide orsellinique se forme, entre autres, comme métabolite secondaire chez Aspergillus nidulans[8],[9],[10]. La formation d'acide orselique peut être déclenchée spécifiquement par un contact physique étroit avec des bactéries voisines ou par une mutation du complexe de signalosomes[11]. L'acide orselique, l'orcinol et l'acide pénicillique se trouvent dans des cultures de Penicillium fennelliae[12]. Il joue un rôle dans la biochimie des lichens à partir desquels il peut être isolé[13]. Il est en effet un monomère courant des depsides, à la base par exemple de l'acide gyrophorique ou l'acide umbilicarique, deux composés particulièrement courants dans certaines espèces de lichens.
La biosynthèse de l'acide orselique se fait par la voie des polycétides, dans laquelle de simples groupes acyles activés par la coenzyme A (principalement l'acétyl-CoA) forment un tétracétide qui est ensuite cyclisé[14],[15].
Pour A. nidulans, le gène codant une synthase d'acide orsellinique (OAS) a été identifié, qui est similaire à une synthase polycétidique non réductrice typique. Les informations sur la séquence fournissent des indices sur les étapes de cette voie de biosynthèse. On suppose qu'une molécule d'acide orselique peut être formée à partir de trois molécules de malonyl-CoA et d'une acétyl-CoA liée à une enzyme. L'acétyl-CoA sert de molécule de départ pour la synthèse,

Synthèse[modifier | modifier le code]
Une synthèse peut être réalisée par addition de Michael de l'acétoacétate d'éthyle sur l'acide crotonique suivie d'une condensation de Dieckmannintramoléculaire. Cela conduit à la formation de dihydroorsellinate d'éthyle. La déshydrogénation et le clivage de l'ester conduisent à l'acide orsellinique.
L'acide orselique peut aussi être produit par oxydation de l'orsellaldéhyde[16],[17].
Il peut également être produit par réaction entre l'acide éverninique et l'acide ramalique à ébullition en présence d'hydroxyde de baryum, ce qui rompt leurs liaisons ester[6].
Une autre synthèse part de l'orcinol qui est carboxylé avec du carbonate de méthylmagnésium dans le DMF[7] :
Notes et références[modifier | modifier le code]
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Orsellinsäure » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Acide orsellinique », sur ChemIDplus, consulté le 17 janvier 2011
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne), p. 182
- « Fiche du composé 2,4-Dihydroxy-6-methylbenzoic acid hydrate », sur Alfa Aesar (consulté le ).
- (en) Nolan, T. J.; Keane, J.; Davidson, V. E., « Chemical constituents of the lichen Parmelia latissima Fee », Scientific Proceedings of the Royal Dublin Society, Series A, vol. 22, , p. 237–239
- Russell, R. et C Kemmelmeier, « Neutral, alkaline and difference ultraviolet spectra of secondary metabolites from Penicillium and other fungi, and comparisons to published maxima from gradient high-performance liquid chromatography with diode-array detection. », Journal of Chromatography, vol. 511, , p. 195–221 (PMID 2211911, DOI 10.1016/S0021-9673(01)93285-6)
- (de) R. Hegnauer, Chemotaxonomie der Pflanzen : Band 1: Thallophyten, Bryophyten; Pteridophyten und Gymnospermen, Bâle, Birkhäuser, (lire en ligne), p. 160
- Volker Schroeckh, Kirstin Scherlach, Hans-Wilhelm Nützmann, Ekaterina Shelest, Wolfgang Schmidt-Heck, Julia Schuemann, Karin Martin, Christian Hertweck, Axel A. Brakhage, « Intimate bacterial-fungal interaction triggers biosynthesis of archetypal polyketides in Aspergillus nidulans », Proceedings of the National Academy of Sciences of the United States of America, vol. 106, no 34, , p. 14558–14563 (DOI 10.1073/pnas.0901870106}, lire en ligne)
- Michael Ramm : Bakterien induzieren Wirkstoffsynthese in Pilzen. Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie - Hans-Knöll-Institut (HKI)
- James F. Sanchez, Yi-Ming Chiang, Edyta Szewczyk, Ashley D. Davidson, Manmeet Ahuja, C. Elizabeth Oakley, Jin Woo Bok, Nancy Keller, Berl R. Oakley, Clay C. C. Wang, « Molecular genetic analysis of the orsellinic acid/F9775 gene cluster of Aspergillus nidulans », Mol Biosyst., vol. 6, no 3, , p. 587–593 (PMID 20174687, PMCID 2903553, DOI 10.1039/B904541D)
- Krystyna Nahlik, Marc Dumkow, Özgür Bayram, Kerstin Helmstaedt, Silke Busch, Oliver Valerius, Jennifer Gerke, Michael Hoppert, Elke Schwier, Lennart Opitz, Mieke Westermann, Stephanie Grond, Kirstin Feussner, Cornelia Goebel, Alexander Kaever, Peter Meinecke, Ivo Feussner, Gerhard H. Braus, « The COP9 signalosome mediates transcriptional and metabolic response for hormones, oxidative stress protection and cell wall rearrangement during fungal development », Molecular Microbiology, vol. 78, no 4, , p. 964–979 (DOI 10.1111/j.1365-2958.2010.07384.x)
- G. W. Eijk, « Isolation and identification of orsellinic acid and penicillic acid produced by Penicillium fennelliae Stolk », Antonie van Leeuwenhoek, vol. 35, no 1, , p. 497–504 (DOI 10.1007/BF02219167)
- T. J. Nolan, J. Keane, V. E. Davidson, « Chemical constituents of the lichen Parmelia latissima Fee », Scientific Proceedings of the Royal Dublin Society, Series A, vol. 22, , p. 237–239
- Klaus Mosbach, « Die Biosynthese der Orsellinsäure und Penicillinsäure (I) », Acta Chem. Scand., vol. 14, , p. 457–464 (lire en ligne)
- Klaus Mosbach, « Die Rolle der Malonsäure in der Biosynthese der Orsellinsäure », Naturwissenschaften, vol. 48, no 15, , p. 525–525 (DOI 10.1007/BF00595346)
- Kang, Ying, Mei, Yan, Du, Yuguo et Jin, Zhendong, « Total Synthesis of the Highly Potent Anti-HIV Natural Product Daurichromenic Acid along with Its Two Chromane Derivatives, Rhododaurichromanic Acids A and B », Organic Letters, vol. 5, no 23, , p. 4481–4484 (PMID 14602030, DOI 10.1021/ol030109m)
- Kurt Hoesch, « Synthese der Orsellinsäure und der Everninsäure », Berichte der deutschen chemischen Gesellschaft, vol. 46, no 1, , p. 886–892 (DOI 10.1002/cber.191304601116)