2-Bromopropane
| 2-Bromopropane | |||
    |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2-Bromopropane | ||
| Synonymes |
Bromure d'isopropyle, bromure de 2-propyle, bromure isopropylique |
||
| No CAS | |||
| No ECHA | 100.000.778 | ||
| No CE | 200-855-1 | ||
| No RTECS | TX4111000 | ||
| PubChem | 6358 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore de même odeur que le chloroforme[1] | ||
| Propriétés chimiques | |||
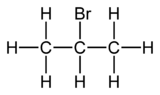
| Formule | C3H7Br [Isomères] |
||
| Masse molaire[2] | 122,992 ± 0,004 g/mol C 29,3 %, H 5,74 %, Br 64,97 %, |
||
| Propriétés physiques | |||
| T° fusion | −89 °C[3],[1],[4] | ||
| T° ébullition | 59 °C[3],[1] 59,38 °C[4] |
||
| Solubilité | eau 3,180 g·l-1[5] à 3,2 g·l-1[1] à 20 °C | ||
| Masse volumique | 1,31 g·cm-3 à 25 °C[3] | ||
| Point d’éclair | 19 °C[3] −20 °C[1] |
||
| Limites d’explosivité dans l’air | <4,6%[4] 3,3 vol. % soit 165 g/m3[1] |
||
| Pression de vapeur saturante | 28 kPa à 20 °C[4] 261 mbar à 20 °C 383 mbar à 30 °C 545 mbar à 40 °C 754 mbar à 50 °C[1] |
||
| Viscosité dynamique | 4,894 mPa s à 20 °C[réf. nécessaire] | ||
| Thermochimie | |||
| Cp | 135,6 J·K-1·mol-1[réf. nécessaire] | ||
| Propriétés optiques | |||
| Indice de réfraction | = 1,425[3] | ||
| Précautions | |||
| SGH[3] | |||
| H225, H360F, H373, P201, P210 et P308+P313 |
|||
| NFPA 704[4] | |||
| Transport[3],[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 4837 mg/kg (souris, i.p.)[5] | ||
| CL50 | 36 mg/m3 (inhalation, mammifère (espèce non spécifiée))[5] 31171 ppm/4h (inhalation, souris)[5] |
||
| LogP | 2,14 (octanol-eau)[5] | ||
| Composés apparentés | |||
| Isomère(s) | 1-bromopropane | ||
| Autres composés | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le 2-bromopropane, également connu comme le bromure d'isopropyle, est un hydrocarbure bromé de formule brute C3H7Br et de formule semi-développée CH3–CHBr–CH3. Il se présente sous la forme d'un liquide incolore, utilisé principalement pour introduire un groupe fonctionnel isopropyle en synthèse organique.
Préparation[modifier | modifier le code]
Le 2-bromopropane est disponible dans le commerce. Il peut être obtenu à partir du 2-propanol par réaction avec de l'acide bromhydrique, HBr[6],[7]. L'addition électrophile du bromure d'hydrogène sur le propène suivant la règle de Markovnikov, seul le 2-bromopropane est obtenu :
Le 2-bromopropane peut être aussi préparé de façon standard comme les autres bromures d'alkyle, c'est-à-dire par réaction de l'isopropanol avec du phosphore et du brome[8] ou avec du tribromure de phosphore, PBr3[9].
Enfin, le 2-bromopropane peut être aussi obtenu par une réaction d'Appel sur le 2-propanol avec le tétrabromure de carbone, CBr4 et la triphénylphosphine, PPh3 :
Usage[modifier | modifier le code]
L'atome de brome étant en position secondaire, la molécule de 2-bromopropane peut subir une déshydrohalogénation facilement pour donner du propène, CH2=CH-CH3, qui s'échappe sous forme de gaz. Par conséquent, ce réactif est utilisé en association avec des bases douces, telles que le carbonate de potassium, plutôt qu'avec des bases fortes.
Sécurité[modifier | modifier le code]
Les agents alkylants tels que 2-bromopropane sont souvent cancérigènes.
Autres données[modifier | modifier le code]
- Les positions atomiques dans la molécule ainsi que les charges atomiques sont disponibles on line[10].
- La densité vapeur du 2 bromopropane par rapport à l'air (1) est de 4,24[1] à 4,27[4].
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « 2-Bromopropane » (voir la liste des auteurs) et en allemand « 2-Brompropan » (voir la liste des auteurs).
- Entrée « 2-Bromopropane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23/01/14 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 2-Bromopropane, analytical standard, consultée le 23/01/14., Fiche Sigma-Aldrich du composé 2-Bromopropane 99%, consultée le 23/01/14..
- Fiche MSDS (fichier dont l'extension .php doit être modifiée en .pdf pour être lisible).
- (en) « 2-Bromopropane », sur ChemIDplus.
- Organikum, 19e Ed., Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg, 1993, page 200. (ISBN 3-335-00343-8).
- Merck Index of Chemicals and Drugs, 9th ed. Monograph 5071.
- Oliver Kamm and C. S. Marvel, Alkyl and alkylene bromides, Org. Synth., coll. « vol. 1 », , p. 25
- C. R. Noller and R. Dinsmore, Isobutyl bromide, Org. Synth., coll. « vol. 2 », , p. 358
- données atomiques sur chemmol.com







