Air
| Air | |
| Identification | |
|---|---|
| No CAS | |
| Code ATC | V03 |
| Propriétés chimiques | |
| Masse molaire | 28,965 338 g·mol-1[1] |
| Propriétés physiques | |
| T° fusion | −216,2 °C (1 atm)[2] |
| T° ébullition | −194,3 °C (1 atm, 874,0 kg·m-3)[2] |
| Solubilité | 0,0292 vol/vol (eau, 0 °C)[2] |
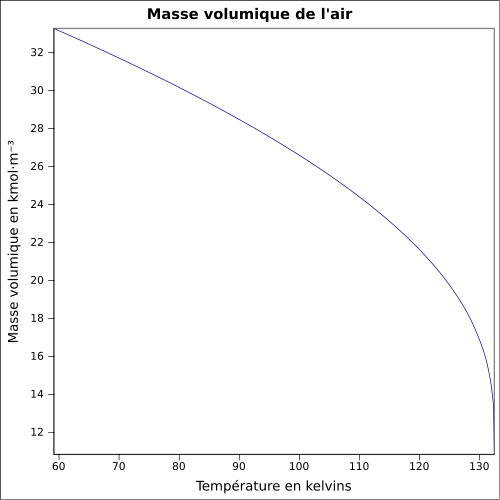
| Masse volumique | 1,2 kg·m-3 (21,1 °C, 1 atm)[2]
|
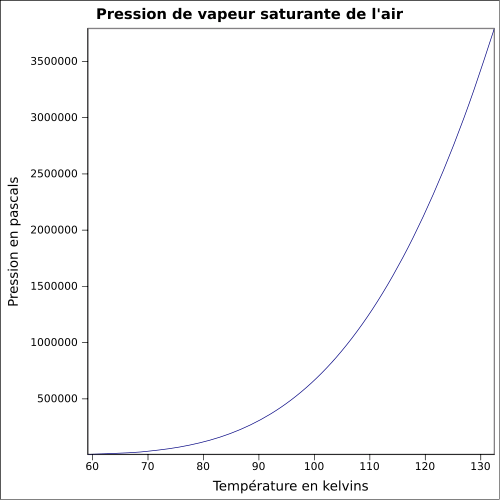
| Pression de vapeur saturante | |
| Point critique | −140,6 °C, 3 771 kPa, 351 kg·m-3[2] |
| Conductivité thermique | 0,023 4 W·m-1·K-1 |
| Thermochimie | |
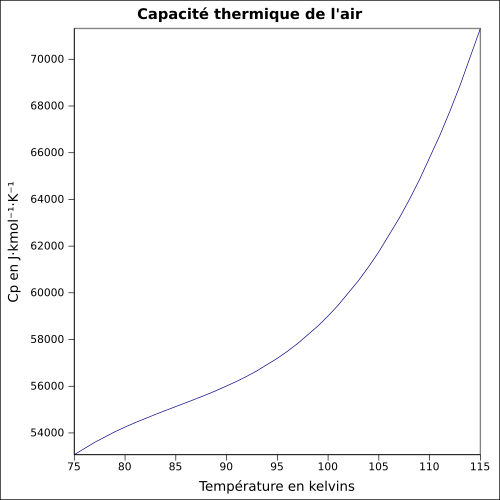
| Cp | |
| Propriétés optiques | |
| Indice de réfraction | 1,000 268 25 (100 kPa, air sec avec 450 ppm de CO2)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'air est un mélange de gaz constituant l'atmosphère de la Terre. Il est normalement incolore, invisible et inodore.
Composition
L'air sec au voisinage du sol est un mélange gazeux homogène. Il est approximativement composé en fraction molaire ou en volume de :
Il contient aussi des traces de dihydrogène 0,000072 % (0,72 ppmv), mais aussi d'ozone, ainsi qu'une présence infime de radon[9]. Il peut aussi contenir du dioxyde de soufre, des oxydes d'azote, de fines substances en suspension sous forme d'aérosol, des poussières et des micro-organismes.
La plupart du temps, l'air de l'environnement terrestre est humide car il contient de la vapeur d'eau. Au voisinage du sol, la quantité de vapeur d'eau est très variable. Elle dépend des conditions climatiques, et en particulier de la température. La pression partielle de vapeur d'eau dans l'air est limitée par sa pression de vapeur saturante qui varie fortement avec la température :
| Température de l'air | −10 °C | 0 °C | 10 °C | 20 °C | 30 °C | 40 °C |
| % de vapeur d'eau
pour une pression d'air de 1 013 hPa |
0 à 0,2 % | 0 à 0,6 % | 0 à 1,2 % | 0 à 2,4 % | 0 à 4,2 % | 0 à 7,6 % |
Le pourcentage de vapeur d'eau présent dans l'air est mesuré par le taux d'hygrométrie, élément important pour les prévisions météorologiques. On parle alors d'humidité absolue, mesurée aussi en unité de masse par volume. L'humidité relative est le pourcentage de la pression partielle de vapeur d'eau par rapport à la pression de vapeur saturante.
Le taux de dioxyde de carbone varie avec le temps. D'une part, il subit une variation annuelle d'environ 6,5 ppmv (partie par million en volume) d'amplitude. D'autre part, le taux moyen annuel augmente de 1,2 à 1,4 ppmv par an. De l'ordre de 384 ppmv (0,0384 %) à mi-2008, il était de 278 ppmv avant la révolution industrielle, de 315 ppmv en 1958, de 330 ppmv en 1974 et de 353 ppmv en 1990. Ce gaz à effet de serre joue un rôle important dans le réchauffement climatique de la planète.
Le méthane est un autre gaz à effet de serre majeur dont le taux augmente avec le temps : 800 mm3/m3 (0,8 ppmv) à l'époque préindustrielle, 1 585 mm3/m3 en 1985, 1 663 mm3/m3 en 1992 et 1 676 mm3/m3 en 1996.
Jusqu'à environ 80 km d'altitude, la composition de l'air est assez homogène, la seule variation remarquable est celle du taux de la vapeur d'eau lié à la température.

Composition de l'air sec
| Nom | Formule | Proportion |
|---|---|---|
| Diazote | N2 | 78,08 %mol[1] |
| Dioxygène | O2 | 20,95 %mol[1] |
| Argon | Ar | 0,934 %mol[1] |
| Dioxyde de carbone | CO2 | 0,04 %mol [1] |
| Néon | Ne | 18,18 ppmv[1] |
| Hélium | He | 5,24 ppmv[1] |
| Monoxyde d'azote | NO | 5 ppmv[1] |
| Krypton | Kr | 1,14 ppmv[1] |
| Méthane | CH4 | 1,9 ppmv |
| Dihydrogène | H2 | 0,5 ppmv[1] |
| Protoxyde d'azote | N2O | 0,5 ppmv[1] |
| Xénon | Xe | 0,087 ppmv[1] |
| Dioxyde d'azote | NO2 | 0,02 ppmv[1] |
| Ozone | O3 | 0–0,01 ppmv[1] |
| Radon | Rn | 6,0×10-14 ppmv[1] |
Les proportions massiques peuvent être évaluées approximativement en multipliant les proportions volumiques par le rapport de la masse molaire du gaz considéré divisé par la masse molaire de l'air soit 28,976 g·mol-1, par exemple dans le cas du CO2. Ce rapport n'est pas négligeable puisqu'il vaut 44/28,976 = 1,52 d'où la teneur massique en CO2 dans l'air égale à 382×1,52 = 580 ppm.
Masse volumique
L'air étant un gaz compressible, sa masse volumique (en kg/m3) est fonction de la pression, de la température et du taux d'humidité.
Pour de l'air sec sous pression atmosphérique normale (1 013,25 hPa) :
On prend généralement 1,293 kg/m3 à 0 °C et 1,204 kg/m3 à 20 °C.
Ceci est généralisé (formule des gaz parfaits) en : (avec T en kelvins et P en pascals selon les conventions SI). Pour une température θ en degrés Celsius, la température T en kelvins est obtenue en ajoutant 273,15 à θ : T(K) = θ(°C) + 273,15.
Potentiel de réchauffement global
Le potentiel de réchauffement global (PRG, en anglais : GWP : Global Warming Potential) ou équivalent CO2 permet de mesurer la « nocivité » de chaque gaz à effet de serre.
Le tableau suivant donne la valeur du PRG pour les principaux gaz à effet de serre présents dans l'air :
| PRG | 1 (référence) | 8[réf. souhaitée] | 23 | 310 | de 1 300 à 1 400 | de 6 200 à 7 100 | 6 500 | 22 800 |
| gaz | dioxyde de carbone | vapeur d'eau | méthane | protoxyde d'azote (N2O) | chlorodifluorométhane (HCFC) | dichlorodifluorométhane (CFC) | tétrafluorure de carbone (CF4) | hexafluorure de soufre (SF6). |
Indice de réfraction
L'expression pour l'indice de réfraction de l'air « aux conditions standard » est[10] :
- où est la longueur d'onde exprimée en nanomètres (nm), là où est la réciproque de la longueur d'onde en micromètres.
C'est pour l'air sec avec 0,03 % de dioxyde de carbone, à une pression de 101 325 Pa (760 millimètres de mercure) et une température de 288,15 kelvins (15 °C).
On peut obtenir n pour une température ou pression différente, en utilisant l'une des deux expressions suivantes :
avec :
- T, température exprimée en kelvins ;
- p, pression en pascals ;
- Ts, 288,15 K ;
- ps, 101 325 Pa ;
- ns, indice de réfraction de l'air donné ci-dessus,
ou :
avec :
- T, température en degrés Celsius ;
- Ts, 15 °C ;
- p, pression en mmHg ;
- ps, 760 mmHg ;
- , 0,00366 K−1 ;
- , (1,049 - 0,015 T) × 10-6 mmHg−1 ;
- , 8,13 × 10-7 mmHg−1 ;
- ns, indice de réfraction de l'air donné ci-dessus.
Propriétés thermophysiques
D'après les tables publiées par Frank M. White, Heat and Mass transfer, Addison-Wesley, 1988.
avec :
- T, température en kelvins ;
- ρ, masse volumique ;
- μ, viscosité dynamique ;
- ν, viscosité cinématique ;
- Cp, chaleur massique à pression constante ;
- λ, conductivité thermique ;
- a, diffusivité thermique ;
- Pr, nombre de Prandtl.
| T | ρ | μ | ν | Cp | λ | a | Pr |
|---|---|---|---|---|---|---|---|
| K | kg·m−3 | kg·m−1·s−1 | m2·s−1 | J·kg−1·K−1 | W·m−1·K−1 | m2·s−1 | - |
| 250 | 1,413 | 1,60×10-5 | 0,949×10-5 | 1 005 | 0,0223 | 1.32×10-5 | 0,722 |
| 300 | 1,177 | 1,85×10-5 | 1,57×10-5 | 1 006 | 0,0262 | 2,22×10-5 | 0,708 |
| 350 | 0,998 | 2,08×10-5 | 2,08×10-5 | 1 009 | 0,0300 | 2,98×10-5 | 0,697 |
| 400 | 0,883 | 2,29×10-5 | 2,59×10-5 | 1 014 | 0,0337 | 3,76×10-5 | 0,689 |
| 450 | 0,783 | 2,48×10-5 | 2,89×10-5 | 1 021 | 0,0371 | 4,22×10-5 | 0,683 |
| 500 | 0,705 | 2,67×10-5 | 3,69×10-5 | 1 030 | 0,0404 | 5,57×10-5 | 0,680 |
| 550 | 0,642 | 2,85×10-5 | 4,43×10-5 | 1 039 | 0,0436 | 6,53×10-5 | 0,680 |
| 600 | 0,588 | 3,02×10-5 | 5,13×10-5 | 1 055 | 0,0466 | 7,51×10-5 | 0,680 |
| 650 | 0,543 | 3,18×10-5 | 5,85×10-5 | 1 063 | 0,0495 | 8,58×10-5 | 0,682 |
| 700 | 0,503 | 3,33×10-5 | 6,63×10-5 | 1 075 | 0,0523 | 9,67×10-5 | 0,684 |
| 750 | 0,471 | 3,48×10-5 | 7,39×10-5 | 1 086 | 0,0551 | 10,8×10-5 | 0,686 |
| 800 | 0,441 | 3,63×10-5 | 8,23×10-5 | 1 098 | 0,0578 | 12,0×10-5 | 0,689 |
| 850 | 0,415 | 3,77×10-5 | 9,07×10-5 | 1 110 | 0,0603 | 13,1×10-5 | 0,692 |
| 900 | 0,392 | 3,90×10-5 | 9,93×10-5 | 1 121 | 0,0628 | 14,3×10-5 | 0,696 |
| 950 | 0,372 | 4,02×10-5 | 10,8×10-5 | 1 132 | 0,0653 | 15,5×10-5 | 0,699 |
| 1 000 | 0,352 | 4,15×10-5 | 11,8×10-5 | 1 142 | 0,0675 | 16,8×10-5 | 0,702 |
| 1 100 | 0,320 | 4,40×10-5 | 13,7×10-5 | 1 161 | 0,0723 | 19,5×10-5 | 0,706 |
| 1 200 | 0,295 | 4,63×10-5 | 15,7×10-5 | 1 179 | 0,0763 | 22,0×10-5 | 0,714 |
| 1 300 | 0,271 | 4,85×10-5 | 17,9×10-5 | 1 197 | 0,0803 | 24,8×10-5 | 0,722 |
Source : informations du site Chemical Professionals[11].
La relation entre la température et la conductivité thermique de l'air, valable pour une température comprise entre 100 K et 1 600 K est la suivante[12] :
où :
- : température exprimée en K
- : conductivité thermique en
La relation entre la viscosité dynamique de l'air et la température est :
où :
- : température en K
- : viscosité dynamique en
La relation entre la viscosité cinématique de l'air et la température est :
où :
- : température en K
- : viscosité cinématique en
D'après les informations du WPI[13], la relation entre chaleur spécifique de l'air et la température est la suivante :
où :
- : température en K
- : chaleur spécifique en J·kg−1·K−1
Pression
Du fait de la diminution de la pression de l'air avec l'altitude, il est nécessaire de pressuriser les cabines des avions et autres aéronefs. En pratique, la pression imposée dans les cabines est supérieure à la pression extérieure, bien que moindre que la pression au niveau du sol.
De l'air comprimé est également utilisé dans la plongée sous-marine.
Liquéfaction
L'air est formé de différents gaz qui, si on les refroidit suffisamment, finissent par passer à l'état liquide, puis à l'état solide. Par exemple, l'oxygène devient solide à la température de −218 °C, l'azote se liquéfie à −195 °C. À la température de −270 °C (environ 3 K), tous les gaz sauf l'hélium sont alors solides et on obtient de « l'air congelé ». L'air n'a pu être liquéfié avant que ne soient connues les pressions et températures critiques qui marquent les limites théoriques au-delà desquelles un composé ne peut exister qu'à l'état gazeux. L'air étant un mélange, ces valeurs n'ont pas de sens strict, mais, en fait, à une température supérieure à −140 °C, l'air n'est plus liquéfiable.
Température d'ébullition des composants de l'air
| Nom | Formule | Température |
|---|---|---|
| Diazote | N2 | −195,79 °C, azote liquide |
| Dioxygène | O2 | −183 °C, oxygène liquide |
| Argon | Ar | −185,85 °C |
| Dioxyde de carbone | CO2 | −56,6 °C sous 5,12 atm |
| Néon | Ne | −246,053 °C |
| Hélium | He | −268,93 °C, hélium liquide |
| Monoxyde d'azote | NO | −151,8 °C |
| Krypton | Kr | −154,34 °C |
| Méthane | CH4 | −161,52 °C |
| Dihydrogène | H2 | −252,76 °C, hydrogène liquide |
| Protoxyde d'azote | N2O | −88,5 °C |
| Xénon | Xe | −108,09 °C |
| Dioxyde d'azote | NO2 | +21,2 °C |
| Ozone | O3 | −111,9 °C |
| Radon | Rn | −61,7 °C |
Les premières gouttes d'air liquide ont été obtenues presque simultanément par Louis Paul Cailletet et Raoul-Pierre Pictet en 1877, par détente brutale entre 300 et 1 atmosphère.
En 1894, le physicien néerlandais Heike Kamerlingh Onnes mit au point la première installation d’air liquide. Pendant les quarante années qui suivirent, des chercheurs en France, Grande-Bretagne, Allemagne et Russie apportèrent de nombreuses améliorations au procédé. Sir James Dewar liquéfia d’abord l’hydrogène, en 1898, et Heike Kamerlingh Onnes l’hélium, le gaz le plus difficile à liquéfier, en 1908. Indépendamment de Carl von Linde, Georges Claude mit au point dès 1902 un procédé industriel de liquéfaction de l’air.
Symbolique
- Dans un domaine non scientifique, l'air est l'un des quatre éléments (avec le feu, l'eau et la terre) que l'on considérait autrefois (et que l'on considère encore dans certaines cultures) comme les substances sur lesquelles serait basée toute la vie. Il est le symbole de l'Esprit.
- L'air est également souvent associé à différents autres concepts tels que la famille des épées dans les jeux de tarot.
Notes et références
- « Air », sur olivier.fournet.free.fr (consulté le )
- (en) Compressed Gas Association, Handbook of compressed gases, Springer, , 4e éd., 702 p. (ISBN 0-412-78230-8, lire en ligne), p. 234
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Philip E. Ciddor, « Refractive index of air: new equations for the visible and near infrared », Applied Optics, vol. 35, no 9, , p. 1566-1573 (DOI 10.1364/AO.35.001566)
- (en) The keeling curve, sur le site keelingcurve.ucsd.edu, consulté le 23 avril 2015
- Concentration de CO2 dans l'atmosphère terrestre
- Concentration du CO2 mesurée à Mauna Loa (Hawaï), NOAA.
- Concentration du méthane mesurée à Mauna Loa (Hawaï), NOAA.
- L'air fortement asséché contient en pratique encore des traces de vapeur d'eau.
- « Indice de réfraction de l'air », sur olivier.fournet.free.fr (consulté le )
- Chemical Professionals
- Chemical Professionals, non trouvé le 11 août 2013
- Ce document du site de la WPI, sur le site wpi.edu