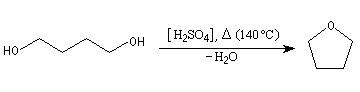Éther-oxyde
Les éther-oxydes, appelés aussi plus simplement éthers, sont des composés organiques de formule générale R-O-R', où R et R' sont des groupes alkyle. Ils sont souvent utilisés en chimie organique pour protéger des fonctions alcool lors de réactions de synthèse. Ils ont d'ailleurs avec ces derniers de nombreuses propriétés communes, dues à la liaison carbone-oxygène et aux doublets libres de l'oxygène (voir la section Géométrie).

Nomenclature[modifier | modifier le code]
En ce qui concerne les éthers non cycliques : par rapport à l'oxygène central, la chaîne alkyle la plus longue est utilisée en suffixe et l'autre chaîne en préfixe de type alcoxy. Exemples : méthoxypropane (CH3-O-C3H7), éthoxyéthane (C2H5-O-C2H5).
Pour ce qui est des éthers cycliques, on utilise le nom qu'aurait un alcane cyclique si l'on remplaçait l'oxygène de l'éther par un carbone, et on rajoute le préfixe « oxa ». Par exemple, pour un éther cyclique avec 3 atomes de carbone et 1 atome d'oxygène : oxacyclobutane. Pour un éther cyclique avec 5 atomes de carbone et 1 atome d'oxygène : oxacyclohexane.
Géométrie[modifier | modifier le code]

Dans le cadre de la théorie VSEPR, la molécule est de type AX2E2 : géométrie tétraédrique, molécule coudée. L'angle R-O-R' est de l'ordre de 109°28', la longueur de la liaison C-O, proche de 140 pm (en théorie 143 pm).
Caractéristiques[modifier | modifier le code]
État[modifier | modifier le code]
Dans les conditions ordinaires, les éthers sont, pour la plupart, des liquides assez volatils. Les points d'ébullition sont assez proches de ceux des alcanes et très inférieurs à ceux des alcools (à cause de l'absence de liaison hydrogène entre deux molécules d'éthers) correspondants.
Solubilité[modifier | modifier le code]
Très grande solubilité dans l'eau pour les éthers ayant des chaînes carbonées courtes (4 atomes de carbone), très faible au-delà de 12 atomes de carbone : en effet, même s'il n'y a pas de liaison hydrogène possible entre deux molécules d'éthers, elles peuvent exister entre l'oxygène de l'éther et les atomes d'hydrogène de l'eau. Du fait de leur miscibilité avec beaucoup de produits organiques, ils sont souvent employés comme solvants.
Polarité[modifier | modifier le code]
Les éther-oxydes sont des molécules polaires (à cause des doublets localisés sur l'oxygène).
Spectroscopie infrarouge[modifier | modifier le code]
| Vibration | Nombre d'onde (cm−1) | Intensité |
|---|---|---|
| C-O-C (asym) | 1 260-1 070 | forte |
| C-O-C (sym) | 1 055-870 | forte |
Réactivité[modifier | modifier le code]
Cette molécule présente donc deux liaisons simples carbone-oxygène et deux doublets libres sur l'oxygène.
- Les doublets donnent aux éther-oxydes des propriétés de base de Brønsted, indifférente dans l'eau (pKA de l'ordre de −3,5) :
mais aussi de base de Lewis.
Ils donnent aussi à l'éther-oxyde des propriétés nucléophiles.
- La liaison C-O étant polarisée, elle est prédisposée à une rupture ionique. Cependant, RO− étant un très mauvais groupe partant (pire que HO−), dans le cadre des alcools, il fait des éther-oxydes des molécules relativement inertes. Cette propriété est utilisée d'ailleurs pour protéger les fonctions alcool.
Il peut y avoir rupture de la liaison C-O, en présence d'halogénure d'hydrogène (principalement iodure) :

Exemples[modifier | modifier le code]
Éthers non cycliques[modifier | modifier le code]
Éther diéthylique[modifier | modifier le code]
L'éther diéthylique est également appelé oxyde de diéthyle ou éthoxyéthane : CH3 — CH2 — O — CH2 — CH3 ou C4H10O.
Dans le langage courant, on le désigne souvent sous le terme d'« éther » (ou « éther sulfurique » ou « éther éthylique »). Il a été utilisé en médecine pour ses propriétés antiseptiques et anesthésiques, et sa capacité à dissoudre les colles (résidus de pansements adhésifs).
Aujourd'hui, il est remplacé pour l'anesthésie humaine par des substances plus fiables et sert principalement de solvant organique courant.
La première synthèse aurait été réalisée par Valerius Cordus en 1540.
Méthyl vinyl éther[modifier | modifier le code]
Le méthyl vinyl éther, CH3-O-CH=CH2, qui porte un groupe vinyle, est le plus simple des éthers alcéniques et est aussi un synthon très utile en synthèse organique, en particulier pour insérer des groupes acyle.
Méthyl tert-butyl éther[modifier | modifier le code]

Le méthyl tert-butyl éther (MTBE) est utilisé pour augmenter l'indice d'octane des carburants. Son utilisation est remise en cause du fait de sa toxicité quand il se retrouve dilué dans l'eau de boisson, par suite de fuites notamment.
Éthers cycliques[modifier | modifier le code]
Les principaux éthers cycliques sont :
| Famille | Nombre de carbones par cycle |
Élément le plus simple de la famille |
Représentation |
|---|---|---|---|
| Oxiranes (plus connus sous le nom d'époxydes) |
2 | Oxyde d'éthylène |  |
| Oxétanes | 3 | Oxyde de 1,3-propylène |  |
| Oxolanes | 4 | Tétrahydrofurane | 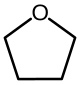 |
| Oxanes | 5 | Tétrahydropyrane |  |
| Oxépanes | 6 | Hexahydrooxépine |  |
Ces éthers cycliques peuvent être utilisés comme solvant pour dissoudre ou pour extraire des produits. Ils peuvent aussi être utilisés comme monomères pour former des polymères par polymérisation par ouverture de cycle.
Éthers couronnes[modifier | modifier le code]

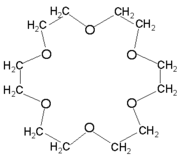
Les éthers couronnes sont une famille chimique de création récente qui, avec les cryptands, ont valu le prix Nobel de chimie en 1987 à Charles Pedersen, Donald J. Cram et Jean-Marie Lehn.
Les plus simples ont 4, 5 ou 6 atomes d'oxygène reliés par des ponts alkyle. Leur cavité centrale permet de piéger des cations tels que Na+, Li+, K+, NH4+ par recouvrement orbitalaire avec les doublets non-liants des atomes d'oxygène.
Des éthers couronnes plus complexes sont produits avec 8 … 30 atomes d'oxygène.
Ce sont des composés dont la toxicité reste à vérifier.
Éthers de glycol[modifier | modifier le code]
Les éthers de glycol sont les dérivés de l'éthylène glycol (éthers de type E : R-O-(CH2-CH2)n-O-R') ou du propylène glycol (éthers de type P : R-O-[CH2-CH(CH2)]n-O-R', isomère alpha). Ce sont des liquides incolores et volatils qui dégagent une odeur agréable.
Ils se dissolvent dans l'eau et dans les graisses (amphiphiles) et passent de ce fait facilement à travers la peau.
Ils sont beaucoup utilisés comme solvant : vernis, peinture, colles, détergents, traitements anti-corrosion, fluides de coupe, dégraissant, mais aussi dans des produits domestiques (nettoyants pour vitres), cosmétiques ou pharmaceutiques.
Les éthers de glycol présentent une toxicité qui est en général faible (pas d'effets immédiats), mais se constate plutôt sur le long terme pour des personnes manipulant de grandes quantités (notamment ouvriers des usines). Plusieurs éthers de glycol sont interdits d'importation dans l'Union européenne. Parmi les effets toxiques, on trouve :
- troubles de la fertilité ;
- cytopénies sanguines, généralement réversibles, qui disparaissent à l'arrêt de l'exposition ;
- génotoxie : certains éthers pénètrent dans les cellules et en modifient le génome.
Synthèses[modifier | modifier le code]
Synthèse de Williamson[modifier | modifier le code]
La synthèse de Williamson consiste à produire des éther-oxydes par substitution nucléophile d'un halogénoalcane par un ion alcoolate.
L'équation générique de la réaction est :
On génère l'ion alcoolate à partir d'un alcool grâce par exemple à un métal réducteur (Na, K) ou encore de l'ion hydrure |H−. Les ions alcoolate ne peuvent exister dans l'eau, on utilise alors souvent comme solvant l'alcool correspondant à l'alcoolate. On peut utiliser aussi d'autres solvants polaires, comme le diméthylsulfoxyde (DMSO) ou le diméthylformamide (DMF).
La synthèse de Williamson est quasiment limitée aux halogénoalcanes primaires (on obtient d'ailleurs un très bon rendement avec eux) ; en effet, pour les halogénoalcanes secondaires ou tertiaires, la réaction concurrente d'élimination (on est en présence de base forte) est très importante. On obtient avec eux un rendement allant du médiocre au très mauvais. On peut faire des synthèses de Williamson intermoléculaires ou intramoléculaires (formation d'éthers cycliques).
Le mécanisme de cette réaction est celui d'une SN2 :
Alcoolyse d'un dérivé halogéné[modifier | modifier le code]
Il est possible de transformer un dérivé halogéné tertiaire ou secondaire en éther-oxyde par alcoolyse. Il suffit de faire réagir un alcool sur un dérivé halogéné. Le mécanisme est alors celui d'une SN1.
Synthèse par déshydratation d'un alcool[modifier | modifier le code]
Le chauffage (modéré, au-delà on obtient de l'éthylène) d'un alcool en présence d'un acide fort (généralement l'acide sulfurique) provoque la déshydratation de l'alcool, avec formation d'un éther-oxyde. Il s'agit d'une déshydratation intermoléculaire d'équation :
Le tétrahydrofurane (THF) (voir ci-dessous) est ainsi synthétisé généralement grâce au butane-1,4-diol mis en présence de l'acide sulfurique.