Oxalate
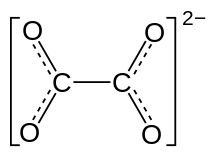
L'ion oxalate, aussi appelé éthanedioate C2O42−, est la dibase conjuguée d'un diacide, l'acide oxalique (ou acide éthanedioïque) H2C2O4, le plus simple des acides dicarboxyliques (HOOC–COOH). Les couples acide/base concernés sont :
- l'acide oxalique et sa base conjuguée l'ion hydrogénoxalate H2C2O4 / HC2O4− ;
- l'ion hydrogénoxalate et sa base conjuguée l'ion oxalate HC2O4− / C2O42−.
Propriétés[modifier | modifier le code]
Demi-équations acide-base[modifier | modifier le code]
- H2C2O4 HC2O4− + H+ constante d'acidité Ka1 = 5,37 × 10−2 (soit pKa1 = 1,27).
- HC2O4− C2O42− + H+ constante d'acidité Ka2 = 5,25 × 10−5 (soit pKa2 = 4,28).
La conséquence de ces deux pKa est que pour une solution ayant un pH autour de la neutralité (pH proche de 7), l'acide oxalique est entièrement transformé en oxalate.
Structure[modifier | modifier le code]
L'anion oxalate peut se lier à un grand nombre de cations : alcalino-terreux (calcium, magnésium), métaux de transition (fer, cuivre, argent, chrome, etc.), métalloïdes (arsenic), mais aussi l'ion ammonium. En fonction du cation, l'anion oxalate peut adopter une structure plane ou non.
Propriétés[modifier | modifier le code]
La solubilité des oxalates est très variable, l'oxalate de magnésium (Mg2+) (produit de solubilité Ks = 8,5 × 10−5) est ainsi 177 fois plus soluble que l'oxalate de calcium (Ks = 2,7 × 10−9)[4]. En effet, le rapport de leurs solubilités respectives est égal à la racine carrée du rapport de leurs produits de solubilité respectifs : . Dans des conditions physico-chimiques identiques (T, pH…), l'oxalate de calcium est donc nettement plus susceptible de précipiter que l'oxalate de magnésium. L'oxalate de magnésium est aussi un million de fois plus soluble que l'oxalate de mercure.
Parmi les oxalates de métaux, la solubilité diminue selon l'ordre suivant : Mg > Ca > Cd > Zn > {Mn, Ni, Fe, Cu} > {As, Sb, Pb} > Hg.[réf. nécessaire]
Oxalates et santé[modifier | modifier le code]

Occurrence et effet sur la santé[modifier | modifier le code]
Les oxalates cristallisés sont dans certaines conditions toxiques.
Dans le corps humain, l'acide oxalique se combine avec des cations métalliques divalents comme le calcium (Ca2+) et/ou le fer(II) (Fe2+) pour former les cristaux d'oxalates correspondants, qui sont ensuite excrétés dans l'urine sous forme de petits cristaux.
Parfois ces oxalates forment des concrétions plus importantes (calcul rénal pouvant douloureusement obstruer les tubules rénaux). Environ 80 % des calculs rénaux seraient formés à partir d'oxalate de calcium[5]. On observe la formation d'oxalate de calcium après intoxication par liquide antigel, courante chez les enfants et les animaux domestiques. L'oxalate de calcium est en effet formé par l'interaction entre calcium et glycolate, métabolite principal obtenu après ingestion d'éthylène glycol contenu dans de tels produits.
Les patients concernés par certains troubles rénaux, la goutte, la polyarthrite rhumatoïde, ou certaines formes de douleur vulvaire chronique (vulvodynie) devraient éviter les aliments riches en acide oxalique [réf. nécessaire]. Diverses études portent sur des moyens de limiter les risques liés à l'ingestion d'aliments contenant beaucoup d'acide oxalique (rhubarbe, épinards par exemple)[6].
L'oxalate de fer(II) (en) est très insoluble. Il semble jouer un rôle majeur dans la goutte, dans la nucléation et la croissance du très soluble acide urique (urate de sodium), ce qui explique que la goutte apparaisse après quarante ans, quand le taux sanguin de ferritine dépasse 1 µg/L. La bière est riche en oxalate et en fer, et l'éthanol augmente l'absorption du fer ainsi que l'élimination de magnésium, ce pourquoi la consommation de bière augmente considérablement le risque d'une crise de goutte.
Le cadmium catalyse la transformation de la vitamine C en acide oxalique, ce qui est une source de risque pour les personnes dont l'organisme est contaminé par le cadmium via leur alimentation, eau de boisson, le lieu de travail, ou via le tabagisme.
Une étude basée sur le modèle animal (rat de laboratoire) a conclu qu'une supplémentation en calcium associée à des aliments riches en acide oxalique peut faire précipiter l'oxalate de calcium dans l'intestin et fortement réduire le niveau d'oxalate absorbé par le corps (de 97 % dans certains cas)[7],[8].
Une réaction métabolique impliquant l'éthylène glycol (« antigel »), l'acide glyoxylique, ou l'acide ascorbique (vitamine C) peut aussi produire de l'acide oxalique[9].
Quelques champignons (du genre Aspergillus) produisent de l'acide oxalique[10].
Des données préliminaires semblent montrer que l'administration de probiotiques peut significativement diminuer les taux d'excrétion d'acide oxalique[11].
Utilisations[modifier | modifier le code]
De l'oxalate en poudre est utilisé comme pesticide dans les élevages apicoles pour combattre les acariens qui parasitent les abeilles.
Certains complexes utilisant le ligant oxalate sont utilisés comme médicaments. On peut citer par exemple l'oxaliplatine qui est un complexe du platine avec un ligant oxalate et un ligant 1,2-diaminocyclohexane. cette molécule est utilisée pour le traitement contre certains cancers.
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oxalate » (voir la liste des auteurs).
- Robert E. Dinnebier, Sascha Vensky, Martin Panthöfer et Martin Jansen, « Crystal and Molecular Structures of Alkali Oxalates: First Proof of a Staggered Oxalate Anion in the Solid State », Inorganic Chemistry, vol. 42, no 5, , p. 1499–1507 (PMID 12611516, DOI 10.1021/ic0205536).
- CSD Entry WUWTIR: Di-cesium oxalate, Cambridge Crystallographic Data Centre, (DOI 10.5517/cc6fzf0).
- CSD Entry QQQAZJ03: Di-potassium oxalate, Cambridge Crystallographic Data Centre, (DOI 10.5517/cc6fzcy).
- (en) Euler, « Ksp Table: Solubility product constants near 25 °C », sur chm.uri.edu (consulté le ).
- (en) Coe, Evan et Worcester, « Kidney stone disease », The Journal of Clinical Investigation, vol. 115, no 10, , p. 2598–608 (PMID 16200192, PMCID 1236703, DOI 10.1172/JCI26662).
- (en) T. Betsche et B. Fretzdorff, « Biodegradation of oxalic acid from spinach using cereal radicles », Journal of Agricultural and Food Chemistry, vol. 53, no 25, , p. 9751–8 (PMID 16332126, DOI 10.1021/jf051091s).
- (en) Makoto Morozumi, Rayhan Zubair Hossain, Ken'ichi Yamakawa, Sanehiro Hokama, Saori Nishijima, Yoshinori Oshiro, Atsushi Uchida, Kimio Sugaya et Yoshihide Ogawa, « Gastrointestinal oxalic acid absorption in calcium-treated rats », Urological research, vol. 34, no 3, , p. 168–72 (PMID 16705467, DOI 10.1007/s00240-006-0035-7).
- (en) R. Z. Hossain, Y. Ogawa, M. Morozumi, S. Hokama et K. Sugaya, « Milk and calcium prevent gastrointestinal absorption and urinary excretion of oxalate in rats », Frontiers in Bioscience, vol. 8, nos 1–3, , a117–25 (PMID 12700095, DOI 10.2741/1083).
- (en) Mandl, Szarka et Bánhegyi, « Vitamin C: update on physiology and pharmacology », British Journal of Pharmacology, vol. 157, no 7, , p. 1097–1110 (PMID 19508394, PMCID 2743829, DOI 10.1111/j.1476-5381.2009.00282.x).
- (en) Uğur Pabuççuoğlu, « Aspects of oxalosis associated with aspergillosis in pathology specimens », Pathology – Research and Practice, vol. 201, no 5, , p. 363–8 (PMID 16047945, DOI 10.1016/j.prp.2005.03.005).
- (en) J. C. Lieske, D. S. Goldfarb, C. De Simone et C. Regnier, « Use of a probiotic to decrease enteric hyperoxaluria », Kidney international, vol. 68, no 3, , p. 1244–9 (PMID 16105057, DOI 10.1111/j.1523-1755.2005.00520.x).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) Euler, « Ksp Table: Solubility product constants near 25 °C », sur chm.uri.edu (consulté le ).
- (en) Princeton University, « Solubility products (Ksp) constants », sur princetonschools.net (consulté le ).
- Fatma Ibis, Priya Dhand, Sanan Suleymanli, Antoine E. D. M. van der Heijden, Herman J. M. Kramer et Huseyin Burak Eral, « A combined experimental and modelling study on solubility of calcium oxalate monohydrate at physiologically relevant pH and temperatures », Crystals, vol. 10, no 10, , p. 924 (ISSN 2073-4352, DOI 10.3390/cryst10100924).
- Per Ulmgren et Rune Rådeström, « Solubility of calcium oxalate in the presence of magnesium ions, and solubility of magnesium oxalate in sodium chloride medium », Nordic Pulp & Paper Research Journal, vol. 14, no 4, , p. 330–335 (ISSN 2000-0669, DOI 10.3183/npprj-1999-14-04-p330-335).




