Glutamine
| Glutamine | |
 L ou S(+)-glutamine (énantiomère biologique) 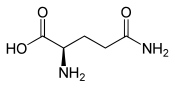 D ou R(–)-glutamine |
|
| Identification | |
|---|---|
| Nom UICPA | acide 2,5-diamino-5-oxopentanoïque |
| Synonymes |
Q, Gln, |
| No CAS | (racémique) (D)ou R(–) (L) ou S(+) |
| No ECHA | 100.000.266 |
| No CE | 200-292-1 (L) |
| Code ATC | B05 |
| PubChem | 738 |
| ChEBI | 28300 |
| FEMA | 3684 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H10N2O3 [Isomères] |
| Masse molaire[1] | 146,144 5 ± 0,006 g/mol C 41,09 %, H 6,9 %, N 19,17 %, O 32,84 %, |
| pKa | 2,17 9,13 |
| Propriétés physiques | |
| T° fusion | décomposition autour de 185 °C |
| Solubilité | soluble dans l'eau |
| Propriétés biochimiques | |
| Codons | CAG, CAA |
| pH isoélectrique | 5,65[2] |
| Acide aminé essentiel | dans certains cas |
| Occurrence chez les vertébrés | 3,7 %[3] |
| Propriétés optiques | |
| Pouvoir rotatoire | +6.5° (H2O, c=2) |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La glutamine (abréviations IUPAC-IUBMB : Gln et Q) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons CAA et CAG. Elle résulte de l'amidification du carboxyle terminal de l'acide glutamique. Elle donne des résidus polaires électriquement neutres et tendant à former des liaisons hydrogène par son groupe amide. Son rayon de van der Waals est égal à 114 Å.
Biochimie[modifier | modifier le code]
La L-glutamine est l'acide aminé libre le plus abondant du sang humain[5].
Tout comme les autres acides aminés, elle joue un rôle biochimique important en tant que constituant des protéines.
Elle est également un élément crucial de la métabolisation de l'azote : l'ammoniac formé par la fixation de l'azote est assimilé en composé organique par la conversion de l'acide glutamique en glutamine. L'enzyme qui permet cette conversion s'appelle la glutamine synthétase. De plus, la glutamine peut être utilisée comme donneur d'azote dans la biosynthèse de nombreux composés, y compris d'autres acides aminés, les purines et les pyrimidines.
Nutrition[modifier | modifier le code]
Étant donné qu'elle peut être synthétisée in vivo à partir de l'acide glutamique, la glutamine n'est pas un acide aminé essentiel mais son rôle dans l'alimentation n'est peut-être pas entièrement compris[6].
La glutamine sert comme supplément dans l'alimentation des assidus de musculation, ainsi que comme traitement des crampes musculaires chez les personnes âgées. Elle permet entre autres une meilleure récupération lors d'efforts physiques importants (sports de force, etc.) et participe à la reconstruction du tissu musculaire endommagé. Elle prévient également le syndrome du surentraînement[7].
Elle diminuerait la fréquence des crises de la drépanocytose[8].
Des études sont menées sur les conséquences néfastes potentielles d'une absorption excessive de glutamine, à ce jour sans résultats probants. Ainsi, sa consommation est supposée saine car elle peut servir à remplir les réserves d'acides aminés qu'une séance d'exercice physique aurait pu vider. C'est pourquoi elle est souvent prescrite aux personnes faisant un jeûne, ou souffrant d'un traumatisme physique, d'un système immunitaire défaillant ou d'un cancer. Néanmoins, des recherches récentes[9] ont mis en évidence le rôle de la glutamine dans la croissance des cellules cancéreuses du foie et des pistes indiquent qu'elle pourrait jouer un rôle également dans les cancers du pancréas et des ovaires.
De plus, certaines études récentes ont été réalisées pour mieux connaître les effets et les propriétés de la glutamine, et celles-ci font apparaître un lien entre une alimentation riche en glutamine et des effets bénéfiques sur l'intestin. La glutamine permettrait notamment d'améliorer l'entretien des fonctions de la paroi intestinale, de la prolifération de la flore intestinale, ainsi que la différenciation cellulaire et une réduction des infections.
Ces propriétés semblent liées à une vitesse d'extraction de la glutamine plus élevée que celle des autres acides aminés, ce qui en ferait donc le meilleur choix pour l'amélioration des conditions du transit intestinal[10].
Ces résultats ont été produits après comparaison de la concentration en plasma des intestins entre des régimes riches et pauvres en glutamine. Pourtant, si la glutamine semble avoir des propriétés « nettoyantes », on ne sait pas encore jusqu'à quel point elle aurait des avantages thérapeutiques, à cause des grandes variations de concentration en glutamine des aliments[10].
Ainsi de récents essais cliniques d'aout 2018 tendraient à montrer que la glutamine apporterait un bénéfice dans le traitement de patients souffrant du syndrome du côlon irritable post infection. En effet elle réduirait les diarrhées ainsi que l'hyper-perméabilité du colon[11],[12].
La glutamine est aussi réputée pour accélérer la guérison après une opération chirurgicale. Les temps de convalescence après une opération de chirurgie abdominale sont réduits si l'on nourrit le patient par intraveineuse avec des mélanges contenant de la glutamine. Les essais en clinique semblent avoir montré que les patients soumis à ce genre de régime, comparés à ceux qui n'avaient pas de glutamine, présentent notamment un meilleur équilibre en azote, une amélioration de la génération des cysteinyl-leucotriènes par les granulocytes, une amélioration de la restauration des leucocytes et de la perméabilité intestinale, le tout sans effets secondaires apparents[13].
Chez les patients graves (en milieu de réanimation), l'apport de glutamine ne semble pas avoir d'action positive et pourrait même avoir une action délétère (mortalité augmentée). Cependant l'étude a inclus des patients remplissant les critères de contre-indication, aussi dans cette étude, des doses de glutamine au-delà du seuil recommandé étaient administrées[14].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Francis A. Carey, « Table of pKa and pI values », sur Département de chimie de l'université de Calgary, (consulté le ).
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le ).
- « Glutamine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) John T. Brosnan, « Interorgan Amino Acid Transport and its Regulation », J. Nutr., (lire en ligne)
- Mobrahan S, 1992. Glutamine - A conditionally essential nutrient or another nutritional puzzle. Nutr Rew, 50: 331-333
- Smith DJ et al.Changes in glutamine and glutamate concentrations for tracking training tolerance. Med Sci Sports Exerc 2000; 32(3):1684-89.
- Niihara Y et coll., « A Phase 3 Trial of l-Glutamine in Sickle Cell Disease. 2018;379:226-35. doi: 10.1056/NEJMoa1715971. », N Engl J Med, 2018;379:226-35 (lire en ligne)
- (en) « LRH-1-dependent programming of mitochondrial glutamine processing drives liver cancer », sur genesdev.cshlp.org (consulté le ).
- Boza J.J., Dangin M., Moennoz D., Montigon F., Vuichoud J., Jarret A., Pouteau E., Gremaud G., Oguey-Araymon S., Courtois D., Woupeyi A., Finot P.A. and Ballevre O. Free and protein-bound glutamine have identical splanchnic extraction in healthy human volunteers. Am J Physiol Gastrointest Liver Physiol. 2001 Jul; 281(1): G267-74. Free text
- Sapreet Basra, G. Nicholas Verne et QiQi Zhou, « 902 Randomized Placebo-Controlled Trial of Glutamine for the Treatment of Diarrhea-Predominant IBS », Gastroenterology, vol. 144, no 5, , S–160 (ISSN 0016-5085, DOI 10.1016/s0016-5085(13)60577-6, lire en ligne, consulté le )
- (en) Zhou QQ, Verne ML, Fields JZ, et al. Gut, « Randomised placebo-controlled trial of dietary glutamine supplements for postinfectious irritable bowel syndrome », BMJ GUT, , p. 68:996–1002.
- Morlion B.J., Stehle P., Wachtler P., Siedhoff H.P., Koller M., Konig W., Furst P., Puchstein C. Total parenteral nutrition with glutamine dipeptide after major abdominal surgery. Ann Surg. 1998 Feb; 227(2): 302-8. .
- Heyland D, Muscedere J, Wischmeyer PE et al. A randomized trial of glutamine and antioxidants in critically ill patients, N Engl J Med, 2013;368:1489-1497
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) Glutamine (Chemie.fu-berlin)
Bibliographie[modifier | modifier le code]
- Jiang Z.M., Cao J.D., Zhu X.G., Zhao W.X., Yu J.C., Ma E.L., Wang X.R., Zhu M.W., Shu H., Liu Y.W. The impact of alanyl-glutamine on clinical safety, nitrogen balance, intestinal permeability, and clinical outcome in postoperative patients: a randomised, double-blind, controlled study of 120 patients. JPEN J Parenter Enteral Nutr. 1999 Sep-Oct;23(5 Suppl):S62-6. .
- Lee, Wha-Joon; Hawkins, Richard A.; Viña, Juan R.; Peterson and R. Darryl, 1998. Glutamine transport by the bloodbrainbarrier : a possible mechanism fornitrogen removal. Am. J. Physiol. CellPhysiol. 274 (4): C1101–1107.
- McAnena O.J., Moore F.A., Moore E.E., Jones T.N. and Parsons P. Selective uptake of glutamine in the gastrointestinal tract: confirmation in a human study. Br J Surg. 1991 Apr; 78(4): 480-2. .

