Chromatine

La chromatine est la structure au sein de laquelle l'ADN se trouve empaqueté et compacté dans le volume limité du noyau des cellules eucaryotes. La chromatine est constituée d'une association d'ADN, d'ARN et de protéines de deux types : histones et non-histones. C'est le constituant principal des chromosomes eucaryotes.
En microscopie, on distingue deux types de chromatine correspondant à des niveaux différents de compaction :
- L'euchromatine correspond à une chromatine moins condensée dans laquelle les gènes, plus accessibles, voient leur expression facilitée.
- L'hétérochromatine correspond à une chromatine plus dense avec un ADN moins facilement accessible.
Outre l'information génétique codée exclusivement sur l'ADN, la chromatine transmet également de l'information épigénétique, portée à la fois par l'ADN dont certaines bases peuvent être modifiées par méthylation, et par les histones qui sont sujettes à de nombreuses formes de modifications réversibles (méthylation, acétylation, phosphorylation, ubiquitinylation...). La combinatoire des modifications épigénétiques affectant les histones constitue un deuxième code, dit "code histones", qui contribue de façon majeure à la régulation des fonctions nucléaires. À la différence de l'information génétique, identique dans toutes les cellules d'un organisme donné, l'information épigénétique varie en fonction du type cellulaire, du niveau de différenciation des cellules et de leur avancée dans le cycle cellulaire. Comme l'information génétique portée par l'ADN, l'information épigénétique est transmissible lors de la réplication du génome et au cours des divisions cellulaires.
Historique[modifier | modifier le code]
La chromatine a été découverte vers 1880 par Walther Flemming, qui lui attribua ce nom en raison de son affinité pour les colorants[1]. Les histones sont découvertes peu après, en 1884 par Albrecht Kossel. Peu de progrès sont ensuite réalisés sur la structure de la chromatine jusque dans les années 1970 et les premières observations de fibres chromatiniennes en microscopie électronique, révélant l’existence du nucléosome, l’unité de base de la chromatine, dont la structure détaillée sera finalement résolue par cristallographie aux rayons X en 1997[2].
Fibre chromatinienne[modifier | modifier le code]

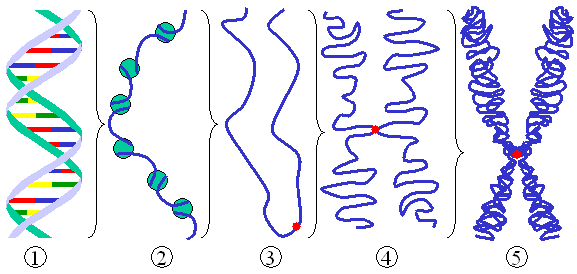
L'élément de base de la chromatine est le nucléosome. Les nucléosomes sont constitués d'un segment de 146 paires de bases d'ADN enroulé autour d'un disque protéique octamère, un assemblage de 8 molécules d'histones H2A, H2B, H3 et H4. Les nucléosomes s'enchaînent sur l'ADN pour constituer une structure en collier de perles (structure rarissime dans la cellule, les nucléosomes sont en fait empilés les uns sur les autres). Avec l'addition d'histones H1, le filament nucléosomique, appelé aussi la fibre de 10 nm est à son tour compacté sous forme de fibres de 30 nm de diamètre[n 1],[3], constituant l'unité de base de la chromatine. Cette fibre elle-même peut être plus ou moins condensée (sur-enroulée). Au niveau ultrastructurel, en microscopie électronique, on distingue l'euchromatine, peu dense, qui contient les gènes actifs et l'hétérochromatine, dense.
En début de mitose, la chromatine se condense sous forme de chromosomes.
Types de chromatine[modifier | modifier le code]
Deux types de chromatine peuvent être distingués :
- l'euchromatine, qui consiste en ADN actif, de structure globalement décondensée permettant l'expression génique ;
- l'hétérochromatine, régions d'ADN condensé qui consiste en ADN principalement inactif. Il semble servir à des fins structurelles durant les phases chromosomiques. L'hétérochromatine peut à son tour se subdiviser en deux types :
- l'hétérochromatine constitutive, qui n'est globalement pas exprimée. Elle est située autour des centromères et des télomères et consiste en général en des séquences répétitives ;
- l'hétérochromatine facultative, qui contient généralement des gènes éteints. Le transcriptome de la cellule est régulé par cette structure, ainsi les cellules en stade final de différenciation (qui doivent donc exprimer un nombre de gènes restreint, assurant juste leur métabolisme et leur fonction) présentent de nombreuses régions de cette hétérochromatine facultative. L'exemple le plus fréquemment donné est l'inactivation d'un des deux chromosomes X chez les mammifères.
Influence de la structure chromatinienne sur l'expression génique[modifier | modifier le code]

Le contrôle de la structure chromatinienne est aussi un mode de contrôle de l'expression génique. En effet, l'ADN pour être exprimé doit être décompacté, un complexe de remodelage intervient donc pour désorganiser les histones afin de permettre la fixation de facteurs trans sur l'ADN et son expression.
Aussi les histones, comme l'ADN, sont soumises à des modifications chimiques régulant l'expression génique. Ces modifications ne concernent que la partie N-Terminale des histones H2A, H2B, H3 et H4, alors qu'elles concernent aussi bien l'extrémité C-Terminale que N-Terminale chez l'histone H1. Une méthylation des résidus lysine aura généralement un effet inhibiteur, réprimant l'expression du génome; alors que son acétylation couplé à une méthylation des arginines aura plutôt un effet activateur réduisant les charges positives de celle-ci et participant ainsi à sa désorganisation. On remarque en effet qu'à certains complexes de répression sont associées des activités désacétylases.
Notes et références[modifier | modifier le code]
Notes[modifier | modifier le code]
- Son existence est remise en cause (Fussner, Ching et Bazett-Jones 2011)
Références[modifier | modifier le code]
- Donald E. Olins et Ada L. Olins, « Chromatin history: our view from the bridge », Nature Reviews. Molecular Cell Biology, vol. 4, no 10, , p. 809–814 (ISSN 1471-0072, PMID 14570061, DOI 10.1038/nrm1225, lire en ligne, consulté le )
- Luger, Mäder, Richmond et Sargent, 1997.
- Németh et Längst, 2004
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) Karolin Luger, Armin W. Mäder, Robin K. Richmond, David R. Sargent et Timothy J. Richmond, « Crystal structure of the nucleosome core particle at 2.8 A resolution », Nature, vol. 389, no 6648, , p. 251–260 (PMID 9305837, DOI 10.1038/38444)
- (en) Attila Németh et Gernot Längst, « Chromatin higher order structure: opening up chromatin for transcription », Brief. Funct. Genomic Proteomic, vol. 2, no 4, , p. 334-343 (PMID 15292447)
- (en) Donald E. Olins et Ada L. Olins, « Chromatin history: our view from the bridge », Nat. Rev. Mol. Cell Biol., vol. 4, no 10, , p. 809–814 (PMID 14570061, DOI 10.1038/nrm1225)
- (en) Igor Ya Belyaev, Yevgeny D Alipov et Mats Harms-Ringdahl, « Effects of zero magnetic field on the conformation of chromatin in human cells », Biochimica et Biophysica Acta (BBA) - General Subjects, vol. 1336, no 3, , p. 465–473 (DOI 10.1016/S0304-4165(97)00059-7, lire en ligne, consulté le )
- (en) Eden Fussner, Reagan W. Ching et David P. Bazett-Jones, « Living without 30nm chromatin fibers. », Trends Biochem Sci., vol. 36, no 1, , p. 1-6 (PMID 20926298, DOI 10.1016/j.tibs.2010.09.002)
