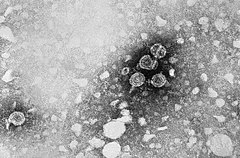
Virus de l'hépatite B
| Groupe | Groupe VII |
|---|---|
| Famille | Hepadnaviridae |
| Genre | Orthohepadnavirus |
Le virus de l'hépatite B ou VHB (en anglais, Hepatitis B virus ou HBV) est un virus qui provoque l'hépatite B chez l'humain.
Ce virus appartient au groupe taxinomique VII du règne des Virus, à la famille des Hepadnaviridae et au genre Orthohepadnavirus. La famille des hépadnavirus (Hepadnaviridae) regroupe les virus dont le génome est constitué d'ADN double brin, qui possèdent une activité de rétrotranscription et qui causent des infections du foie chez les humains et certains animaux. Chaque virus est spécifique d'une espèce mais il peut infecter des animaux phylogénétiquement proches. C'est le cas du VHB qui est spécifiquement humain, mais qui peut infecter certains autres primates.
La transmission du VHB se fait par le sang et ses dérivés (salive, sperme et sécrétions vaginales), les virus se multiplient ensuite dans les cellules hépatiques.
Morphologie[modifier | modifier le code]
La particule virale (ou particule de Dane) ou HBc est sphérique et mesure 42-47 nm de diamètre. Le génome est contenu dans une nucléocapside icosaédrique de 22-25 nm de diamètre enveloppée par une bicouche lipidique associée à des protéines de surface.
Son enveloppe porte notamment l’antigène de surface HBs, ou protéine HBsAg, tandis que sa partie plus centrale, porteuse de la charge virale, porte l'antigène HBc[1].
Génome[modifier | modifier le code]
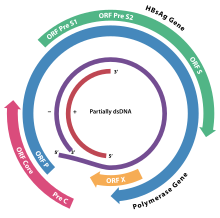
Le génome est formé d’ADN circulaire (3200 nucléotides) partiellement double brin (sur les deux tiers de sa longueur).
Le virus possède un brin long (L-) d’une longueur de 3,2 kb fixe entre les différents mutants, et un brin court (S+) de longueur variable, de 50 à 100 % de celle du brin L-.
Il existe quatre régions ouvertes dans le génome correspondant à quatre phases de lectures ouvertes situées sur le brin L- :
- la région S, qui code les protéines d’enveloppe. Une protéine S ou protéine majeure de 24 kDa (= antigène HBs), une protéine moyenne de 34 kDa et une grande protéine de 39 kDa ;
- la région C, qui code la protéine de core p22c de 22 kDa et une protéine non structurale p17e de 17 kDa (= antigène HBe) ;
- la région P, qui code l’ADN polymérase virale de 82 kDa. Cette enzyme possède à la fois des activités de transcriptase inverse, d’ADN polymérase ADN-dépendante et de RNase H ;
- la région X, qui code un polypeptide de 145 à 154 acides aminés (dépendant du sous-type du virus). Ce polypeptide ou protéine X est une protéine transactivatrice du génome viral et cellulaire, elle a un potentiel oncogénique.
Variabilité et évolution[modifier | modifier le code]
Variabilité[modifier | modifier le code]

Il existe différents sous-types du VHB définis par une variabilité dans les épitopes de l'antigène HBs, due à une hétérogénéité du génome viral. On distingue ainsi huit souches du VHB, nommées de A à H. Certaines de ces souches sont surtout présentes dans certaines régions du Globe :
- souche A : en Europe de l'Ouest ;
- souches B et C : en Asie ;
- souches D et E : dans le bassin méditerranéen ;
- souche H : en Amérique centrale.
Évolution[modifier | modifier le code]
La paléovirologie montre que des virus endogènes appartenant à la famille des Hepadnaviridae (à laquelle appartient le VHB) s'étaient intégrés dans le génome d'un groupe de passereaux il y a plus de 19 millions d'années. On ne sait pas encore, en revanche, si le VHB ou un virus proche circule encore aujourd'hui chez les passereaux[2].
En 2021, une étude de l'ADN viral préservé dans 137 squelettes humains vieux de 10 500 à 400 ans éclaire l'évolution du virus chez l'humain[3],[4] :
- le dernier ancêtre commun à l'ensemble des variants connus date de 20 000 à 12 000 ans, donc de la dernière période glaciaire et bien après la sortie d'Afrique des humains modernes ;
- vers 12 000 ans (début de l'Holocène), le virus se sépare en deux lignées, la branche amérindienne et la branche eurasienne. La branche amérindienne évolue ensuite, conduisant aux actuelles souches F et H ;
- en Eurasie, l'évolution du virus est complexe, liée notamment aux grandes migrations humaines. Vers 6 000 ans, une souche nommée WENBA remplace les souches mésolithiques, puis elle se fait elle-même supplanter, vers 2 000 ans et rapidement, par les actuelles souches A et D, plus virulentes (à la suite de la perte d'un fragment d'ADN, affectant une protéine de surface) ;
- la souche G, rare mais réapparue avec la pandémie du sida, est la seule souche héritée de la grande diversité préhistorique du VHB.
Tropisme[modifier | modifier le code]
Le VHB cible les hépatocytes et certaines cellules extra-hépatiques comme les cellules mononucléées du sang.
Cycle de réplication[modifier | modifier le code]

- Le virion reconnaît et s’attache à l’hépatocyte via le récepteur NTCP[5].
- Fusion entre l’enveloppe virale et la paroi cellulaire, libération de la nucléocapside dans le cytoplasme.
- Translocation de la nucléocapside vers le noyau grâce à des signaux de localisation nucléaire portés par l’antigène HBc. Pénétration de l’ADN du VHB dans le noyau.
- Par un mécanisme encore mal connu, l’ADN asymétrique ouvert dans la particule, devient double brin circulaire fermé de façon covalente dans le noyau. On parle alors d’ADNccc (Covalently Closed Circular DNA). L’ADNccc s’associe à des histones cellulaires pour former un « mini chromosome », l’ADN est à ce moment superenroulé. Un ARN prégénomique est transcrit par une ARN polymérase II cellulaire à partir du brin L- de cet ADN superenroulé.
- Cet ARN prégénomique synthétisé migre dans le cytoplasme et sert de matrice pour la synthèse de l’antigène HBc et de la polymérase.
- En parallèle, les différents ARNm viraux sont traduits en protéines virales.
- Les protéines d’enveloppe et la protéine PréC sont dirigées vers le réticulum endoplasmique (RE).
- L’antigène HBe et les protéines d’enveloppe passent dans l’appareil de Golgi.
- L’antigène HBe et les particules virales vides, constituées exclusivement de protéines d’enveloppe, sont sécrétés.
- De leur côté, l’ARN prégénomique et la polymérase sont recrutés dans les capsides néoformées par l’antigène HBc.
- Le brin long d’ADN est synthétisé dans la capside par un processus de transcription inverse par l’ADN polymérase virale (étape apparentée au cycle de réplication des rétrovirus).
- La synthèse du brin court S+ débute ensuite à partir du brin L- d’ADN qui vient d’être formé.
- Les nucléocapsides ont deux devenirs. Une minorité va être recyclée vers le noyau pour maintenir le pool d’ADNccc. L’autre partie, majoritaire, va être envoyée vers le RE.
- Les nucléocapsides sont enveloppées.
- Les particules virales infectieuses sont excrétées à leur tour.
Dynamique de la production virale[modifier | modifier le code]
La production quotidienne du VHB est de l’ordre de 1011 particules, comparée à 109 pour le VIH ou le VHC. La demi-vie du VHB est de 1 à 3 jours. Le niveau de production in vivo élevé du VHB et l’absence de système de correction dans l’ADN polymérase virale influencent la production de variants pouvant échapper au diagnostic et/ou aux traitements.
Notes et références[modifier | modifier le code]
- Wolfram H Gerlich, « Medical Virology of Hepatitis B: how it began and where we are now », Virol J., vol. 2013:10, (DOI 10.1186/1743-422X-10-239, lire en ligne)
- « « Les humains sont apparentés aux virus », un entretien avec Clément Gilbert », sur Passeur des sciences, d'après un article de la revue Nature Reviews Genetics, (consulté le ).
- Coraline Madec, « Hépatite B : les avatars du virus », Pour la science, no 530, , p. 9.
- (en) Arthur Kocher, Luka Papac, Rodrigo Barquera, Felix M. Key, Maria A. Spyrou et al., « Ten millennia of hepatitis B virus evolution », Science, vol. 374, no 6564, , p. 182-188 (DOI 10.1126/science.abi5658, lire en ligne
 , consulté le ).
, consulté le ).
- Huan Yan, Guocai Zhong, Guangwei Xu et Wenhui He, « Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus », eLife, vol. 1, , e00049 (ISSN 2050-084X, PMID 23150796, PMCID 3485615, DOI 10.7554/eLife.00049, lire en ligne, consulté le )
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Les virus transmissibles par le sang, Médecine Sciences Sélection, ouvrage collectif : texte réunis par Jean Jacques Lefrère, 1996.
- Hépatites virales, dépistage, prévention, traitement, Expertise Collective INSERM, 1997.
- Hépatites virales B et C, Pathologie Sciences, C. Trépo, P. Merle, F. Zoulim, 2006.
- Les hépatites virales, 2e édition MASSON, C. Eugène, L. Costentin, S. Beaulieu, 2004.
Articles connexes[modifier | modifier le code]
- Hépatite virale
- Hépatite A (C, D, E, F, G)
- Hépatite B en Chine
Liens externes[modifier | modifier le code]
- Ressources relatives au vivant :
- Ressource relative à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- Fédération SOS hépatites, Fédération d'associations régionales de malades atteints d'hépatites virales
- (en) NIH collection of links to relevant articles on Hepatitis B
- (en) CDC webpage on Hepatitis B