Sulfure de fer(II)
| Sulfure de fer(II) | |

| |
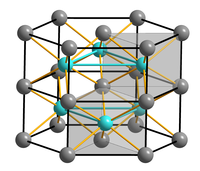 __ Fe2+ __ S2− Structure du sulfure de fer(II) |
|
| Identification | |
|---|---|
| Nom UICPA | Sulfure de fer(II) |
| Synonymes |
sulfure de fer, sulfure ferreux, sulfure de fer noir |
| No CAS | |
| No ECHA | 100.013.881 |
| No CE | 215-268-6 |
| PubChem | |
| Apparence | Solide gris anthracite à noir d'aspect métallique à cristaux plats ou en forme de bâtonnets |
| Propriétés chimiques | |
| Formule | FeS |
| Masse molaire[1] | 87,91 ± 0,007 g/mol Fe 63,53 %, S 36,48 %, |
| Propriétés physiques | |
| T° fusion | 1 195 °C [2] |
| Solubilité | Ks = 10-16,4 |
| Masse volumique | 4,84 g·cm-3 (20 °C)[2] |
| Thermochimie | |
| S0solide | 60,3 J·K-1·mol-1 à 25 °C [3] |
| ΔfH0solide | −100,0 kJ·mol-1 à 25 °C [3] |
| ΔfusH° | 31,5 kJ·mol-1 à 1 188 °C [3] |
| Cp | 50,5 J·K-1·mol-1 (25 °C, cristaux)[3] |
| Cristallographie | |
| Structure type | NiAs[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sulfure de fer(II), encore appelé sulfure ferreux, est le composé chimique de formule FeS. À l'instar de l'oxyde de fer(II), c'est un composé non-stœchiométrique. Il est pyrophorique (s'enflamme spontanément dans l'air) à l'état pulvérulent.
Différents sulfures de fer[modifier | modifier le code]
Il existe plusieurs variétés de sulfures fer, qui diffèrent les unes des autres par leur stœchiométrie et leurs propriétés[5], présentant certaines analogies avec les oxydes correspondants :
- la pyrrhotite, un minéral ferromagnétique, comme le fer, de formule Fe1-xS cristallisant dans le système monoclinique.
- la troïlite, une variété stœchiométrique de pyrrhotite, de formule FeS, ayant une symétrie hexagonale
- la mackinawite, le moins stable des sulfures de fer, avec une structure en couches de formule Fe1+xS
- la pyrite et la marcassite, des minéraux diamagnétiques, qui sont des disulfures de fer(II) de formule FeS2
- la greigite, un sulfure de fer(II,III) de formule Fe3S4 analogue à la magnétite Fe3O4 quant à ses propriétés ferromagnétiques.
Le sulfure de fer(III), de formule Fe2S3, est plutôt instable et tend à se dissocier en soufre et sulfure de fer(II).
Réactions chimiques[modifier | modifier le code]
En laboratoire, on peut obtenir le sulfure de fer(II) en faisant réagir directement le fer et le soufre élémentaires, dans une réaction exothermique :
Le sulfure de fer(II) réagit avec l'acide chlorhydrique en donnant du chlorure de fer(II) et du sulfure d'hydrogène :
Biochimie et biologie[modifier | modifier le code]
En environnement hypoxique, les bactéries sulfato-réductrices peuvent dégrader la matière organique en l'oxydant à l'aide des sulfates dissous dans l'eau, ce qui libère du sulfure d'hydrogène susceptible de réagir avec les ions métalliques dissous pour produire des sulfures métalliques insolubles ; ces composés, tels que le sulfure de fer(II), sont souvent bruns ou noirs, conférant une couleur sombre à l'environnement où ils se déposent.
La présence d'un précipité noir de sulfure de fer(II) dans un milieu de culture riche en fer (agar-agar, fer et peptone) permet de repérer les microorganismes qui métabolisent la cystéine à l'aide de la cystéine désulfhydrase, une enzyme qui libère du sulfure d'hydrogène, lequel réagit avec le citrate de fer pour former du sulfure de fer(II).
La même réaction entre H2S et fer se produit lors de la cuisson des œufs durs, à l'interface entre le jaune et le blanc : le fer du jaune s'oxyde au contact du sulfure d'hydrogène libéré par la cuisson du blanc pour former une couche brunâtre de sulfure de fer(II) au contact entre les deux parties de l'œuf[6].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Iron(II) sulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 mai 2010 (JavaScript nécessaire)
- « Ferrous sulfide » dans la base de données Hazardous Substances Data Bank, consulté le 1 mai 2010
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., , 346 p. (ISBN 0-387-26147-8), p. 64
- D. Vaughan, J. Craig, Mineral Chemistry of Metal Sulfides, Cambridge University Press, 1978. (ISBN 0-521-21489-0)
- (en) The Formation Of Ferrous Sulfide In Cooked Eggs
