Stockage de l'hydrogène
Le concept de stockage de l'hydrogène désigne toutes les formes de mise en réserve du dihydrogène en vue de sa mise à disposition ultérieure comme produit chimique ou vecteur énergétique.
Plusieurs possibilités existent, qui présentent avantages et inconvénients. Sous forme de gaz, le dihydrogène est peu dense et doit être fortement comprimé. La liquéfaction du dihydrogène se réalise à très basse température. L'hydrogène solide nécessite d'être lié à d'autres composants, notamment sous la forme d'hydrure.
Enjeux[modifier | modifier le code]
Mobilité[modifier | modifier le code]
L'hydrogène présente plusieurs caractéristiques intéressantes, susceptibles d'en faire un des vecteurs énergétiques du futur. Il dispose notamment d'une densité énergétique massique trois fois plus élevée que celle du gazole[1].
En particulier, il peut facilement être utilisé pour alimenter des moteurs de véhicule : soit dans un moteur à combustion interne, comme dans le cas des véhicules actuels, l'efficacité étant alors limitée par le cycle de Carnot et le rendement plafonnant à environ 25 % ; soit avec un moteur électrochimique utilisant une pile à combustible, l'efficacité n’étant alors pas limitée par le cycle de Carnot, le rendement pouvant atteindre 50 à 60 %.
Apprendre à mieux stocker l'hydrogène est aussi un enjeu d'écomobilité, car l'hydrogène semble être une alternative aux hydrocarbures : en brûlant il n'émet que de la vapeur d'eau et quelques NOx, et pas de CO2 ou de CO[2].
Le coût de stockage mobile du dihydrogène est encore (en 2012) prohibitif et son transport était au début des années 2000 environ 50 % plus cher que celui du gaz naturel[2]. De plus, une unité de volume d’hydrogène transporte trois fois moins d’énergie qu’une unité de volume de gaz naturel[2].
Le stockage, rapidement réversible et sécurisé de quantités importantes d'hydrogène est encore un défi technologique et scientifique. L'atome d'hydrogène, très petit est parmi les plus difficiles à contenir, y compris sous forme de molécule de dihydrogène. Sa liquéfaction nécessite de le refroidir à environ -253 °C (de tous les gaz, seul l'hélium est plus difficile à liquéfier[2]). Cette liquéfaction est à ce jour très consommatrice d'énergie.
Le réseau de distribution est encore modeste. En Europe vers 2010, il desservait essentiellement des industriels et quelques stations-service expérimentales. Il en compte une quarantaine dans le monde en 2012, dont aux États-Unis, au Japon, en Allemagne et en Islande), grâce à environ 1 050 km de pipelines à hydrogène exploités par Air liquide en France, en Allemagne et au Benelux essentiellement. Le réseau de gaz peut également absorber une grande quantité d'hydrogène[2].
Sécurité[modifier | modifier le code]
Des enjeux de sécurité existent aussi car sous forme de gaz diatomique, l'hydrogène est explosif et inflammable. Par rapport aux hydrocarbures, le risque de fuite est plus élevé, et l'énergie requise pour s'enflammer est 10 fois moindre que celle nécessaire pour le gaz naturel. Cependant, il se disperse plus rapidement dans l'air, limitant le risque d'explosion[3]. La réaction avec l'oxygène de l'air est 2 H2 + O2 → 2 H2O.
Encombrement[modifier | modifier le code]
L'hydrogène est l'atome le plus léger, dans les conditions normales[Note 1], dont la masse volumique est de 0,09 kg/m3[4]. Il peut être liquéfié (70 g/L) à −253,8 °C, température difficile à obtenir, ou être compressé par les techniques modernes jusqu'à 700 bars, pression à laquelle il possède une masse volumique de 42 kg/m3, soit 42 g/l[5],[6].
Stockage en réservoir de la molécule H2[modifier | modifier le code]
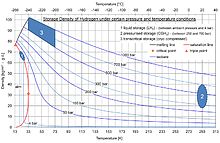
Sous forme gazeuse[modifier | modifier le code]
Basse et moyenne pressions[modifier | modifier le code]
Sous cette forme, il est utilisé principalement pour des applications nomades ou ultra-mobiles se caractérisant par un faible encombrement, un faible poids, une réserve énergétique limitée mais une mise en œuvre très simple.
Les applications les plus courantes sont :
- la réserve d'hydrogène utilisé comme « gaz d'étalonnage » pour l'étalonnage de certains instruments ; l'injection d'une faible quantité de gaz permet de procéder à une opération d'étalonnage de l'appareil ou de l'instrument. Le réservoir d'hydrogène peut être installé à poste dans l'équipement ou porté par le personnel chargé de l'étalonnage;
- la réserve d'énergie, pour du personnel intervenant en milieu isolé ou extrême (froid, obscurité... ) et offrant assez d'énergie pour activer ou recharger un téléphone, un dispositif d'appel, une balise, alimenter les leds d'une lampe frontale, etc.[7]… ou encore pour recharger son téléphone, loin de tout[8].
Haute et très haute pressions[modifier | modifier le code]


Les hautes pressions concernent plutôt des applications mobiles pour lesquelles la réserve d'énergie doit être importante et compacte. Le seul moyen de diminuer le volume d'un gaz à température constante est d'en augmenter la pression dans le réservoir, selon la loi de Boyle-Mariotte.
Les techniques actuelles permettent d'atteindre une pression de 700 bars[9] via un compresseur d'hydrogène (à piston, électrochimique ou à hydrures). À cette pression l’hydrogène possède une masse volumique de 42 kg/m3, soit un gain d’un facteur 500 environ par rapport à sa densité à pression et température ambiantes. Ces réservoirs sont généralement constitués d'une enveloppe (liner) métallique ou en polymère, plus léger, qui doit empêcher la perméation de l'hydrogène. Cette première enveloppe est protégée par une seconde contenant les forces de pression et résistant à d'éventuels chocs ou sources de chaleur, généralement fabriquée en matériaux composites renforcés grâce à un enroulement de filaments (fibre de carbone spécifique, principalement mais d'autres matériaux sont à l'essai comme les fibres de basalte)[réf. nécessaire].
Ces réservoirs font l'objet de qualifications très complexes où on vérifie la résistance à la pression (jusqu'à l'éclatement pour un échantillon du lot), la résistance au feu et la résistance aux chocs (tirs à balles réelles)[réf. nécessaire].
Au début des années 2000, des réservoirs à 200 bars sont maîtrisés, mais il faudrait porter la pression à 700 bars ou plus pour disposer d'un volume embarqué considéré comme offrant un compromis intéressant entre énergie et masse du réservoir[10]. D'autre part, le stockage du gaz à pression atmosphérique nécessiterait idéalement que l'enveloppe du réservoir puisse se déformer tout en restant étanche pour que le gaz puisse y être introduit et en être extrait. La réponse technique n'est pas plus évidente.
Deux voire trois standards coexistent[réf. nécessaire] :
- 350 bars ou 35 MPa pour tout véhicule : voitures particulières[11], bus, engins et camions pour tous les territoires ;
- 500 ou 550 bars pour des engins et camions pour l’Amérique du Nord ;
- 700 bars ou 70 MPa pour les voitures particulières[12],[13].
La « tête de réservoir » doit permettre le remplissage de gaz, l'alimentation de la pile ou du moteur à la pression désirée (grâce à un détendeur intégré), dans de bonnes conditions de sécurité (sans surpression, ni risque d'explosion). Des capteurs doivent aussi informer sur la quantité de gaz restante.
Sous forme liquide[modifier | modifier le code]

Cette solution, encore réservée aux lanceurs spatiaux, pourrait à l'avenir concerner des véhicules terrestres. En effet, l’hydrogène liquide possède une masse volumique de 70,973 kg/m3[14] ; dans ces conditions, le volume du réservoir nécessaire pour stocker les 4 kg d’hydrogène mentionnés plus haut serait de 56 litres, soit le volume du réservoir d'une voiture à essence actuelle.
La difficulté est alors de porter et de maintenir l'hydrogène à une température de −252,8 °C[14]. Le réservoir doit alors ou bien résister à de hautes pressions, ou disposer de systèmes secondaires maintenant l’hydrogène à basse température, et à une pression au moins légèrement supérieure à la pression atmosphérique. En outre, la liquéfaction de l’hydrogène et son maintien en température ont un coût énergétique élevé et, par là, sont polluants[réf. souhaitée].
La cryo-compression (développée depuis 2009 par BMW [15]) pourrait améliorer l'efficacité du stockage volumétrique et massique et ainsi faciliter l'usage d'hydrogène liquide refroidi à très basse température (20,3 K environ).
Quand l'hydrogène se réchauffe et monte en pression sous l'effet de l'apport de chaleur du milieu environnant (comme dans une cocotte-minute), la pression finale avoisine 350 bars (voir par exemple le réservoir liquide développé sur la voiture BMW Hydrogen 7). Pour comparaison, un réservoir d'essence traditionnel ne supporte que quelques bars, et un réservoir GPL 30 bars. Avec les scénarios classiques de conduite, la pression « limite » de 350 bars serait très rarement atteinte (car la pression et la température diminuent dans le réservoir au fur et à mesure que l'hydrogène est consommé).
Le ministère américain de l'énergie (DOE) a publié des « valeurs cibles » concernant la capacité de stockage embarqué pour l'hydrogène[16] et la technologie cryo-compressée a d'ores et déjà atteint les valeurs recommandées pour 2015[17] (de petits réservoirs de 5-13 kg suffisant pour une autonomie de 300 miles avec une pile à hydrogène).
La cryo-compression serait la solution la moins onéreuse parmi les différentes formes de stockage en cours d'étude : le coût pour l'utilisateur final (incluant les coûts de production, liquéfaction, transport et de distribution de l'hydrogène) a été estimé à 0,12 $/mi (soit un peu moins de 0,06 €/km) alors qu'ils sont de 0,05 à 0,07 $/mi (0,024 à 0,034 €/km) pour un véhicule essence traditionnel (voir la diapositive 13[18] pour plus d'informations).
Pour ces raisons, le constructeur allemand BMW avait intégré le "cryo-compressé" comme principal élément du développement de sa filière hydrogène[19], mais cette solution a été (provisoirement ?) abandonnée car ne garantissant pas la conservation du gaz pendant un arrêt prolongé du véhicule, outre les autres risques associés à cette technologie.
Stockage sous forme d'hydrates ou clathrate[modifier | modifier le code]
Il est possible d'introduire une ou plusieurs molécules d'hydrogène dans des « cages d'eau » (clathrates), telles qu'on en trouve dans les profondeurs d'océans, mais à fortes pressions et/ou basse températures. On cherche à le réaliser à des conditions de températures et de pression moins extrêmes[20],[21],[22].
Stockage « sur » des composés solides (adsorption)[modifier | modifier le code]
L'adsorption consiste en l’« immobilisation » d’un composé sur la surface d’un autre.
L’hydrogène peut se fixer sur la plupart des surfaces solides mais quasiment seule l’adsorption sur des surfaces de carbone est envisagée pour le stockage, qui n’en est encore qu’aux premières phases de recherche.
Il nécessite des matériaux offrant de grandes surfaces spécifiques, du ressort des nanotechnologies. L’utilisation de nanotubes de carbone est envisagée, mais ils n'adsorbent l'hydrogène qu'à très basse température (−196 °C) ; la piste des cônes de carbone nanométriques est cependant envisagée[23]. Les résultats sont encore trop parcellaires pour pouvoir présager l'avenir de cette solution.
Stockage « dans » des composés solides, en gel ou liquides (hydrures, fullerènes…)[modifier | modifier le code]
Différents composés interagissent avec l'hydrogène par des interactions polaires, offrant des possibilités de rétention intéressantes. Ce sont de petits composés (notamment divers hydrures), l'acide formique) ou des complexes macromoléculaires et cristallins (notamment carbonés, tels les fullerènes).
D'importantes recherches restent à faire pour améliorer leur capacité d’adsorption ou d'absorption[Note 2], et le contrôle du relargage de l'hydrogène.
Hydrures métalliques réversibles[modifier | modifier le code]
Les hydrures sont les composés comportant de l’hydrogène et où celui-ci présente une polarisation négative relativement à l’élément auquel il est lié. On peut classer les hydrures selon la nature de la liaison principale[24] entre l’hydrogène et l’autre élément. Les hydrures sont dits « covalents » quand la liaison est de type covalent. Ils sont dits « métalliques » quand la liaison est de type métallique.
Quelques métaux (purs ou en alliages) absorbent de l’hydrogène en leur sein. Le composé métallique (ex. : magnésium[25]) agit comme une éponge à hydrogène. Dans les hydrures métalliques, l’hydrogène est stocké sous forme atomique (H) et non plus moléculaire (H2) comme dans le cas des réservoirs.
L’absorption d’hydrogène (aussi appelée hydruration) peut être effectuée par l’intermédiaire du gaz dihydrogène (H2) dissocié en deux atomes d’hydrogène (H) à une température et pression données et caractéristiques du matériau absorbant. L’absorption d’hydrogène peut aussi être effectué à température et pression ambiante par voie électrochimique et plus précisément par électrolyse de l’eau.
La capacité de stockage des hydrures métalliques[26],[27] peut être importante ; ainsi, l'alliage Mg2FeH6 « stocke » 150 kg d’hydrogène par mètre cube. Un réservoir de 26 litres serait alors suffisant pour « nos » 4 kg d’hydrogène. Néanmoins, la densité volumique ne suffit pas, il faut encore que l'hydrure soit facilement réversible (a priori par chauffage ou réduction de la pression)[Note 3],[28]. En effet, pour être utilisés dans des applications mobiles, les hydrures métalliques considérés doivent avoir des températures et des pressions d’équilibre compatibles avec les dites applications (entre 1 et 10 bar pour la pression, entre 0 et 100 °C pour la température). Plusieurs familles d’hydrures d’alliages intermétalliques sont envisagées et envisageables : les AB5 (LaNi5…) ; les AB2 (ZrV2) ; les A2B (Mg2Ni)… Les alliages dérivés de LaNi5 sont ceux utilisés dans les batteries rechargeables Nickel-Hydrure Métallique (Ni-MH), dont plusieurs millions d’unités sont vendues à travers le monde chaque année[réf. nécessaire].
En 2011, EADS annonce travailler sur des hydrures de magnésium modifiés à l'échelle nanométrique[29].
Hydrures complexes[modifier | modifier le code]
Des métaux alcalins associés à un élément du groupe 13 (par ex. bore ou aluminium) et d’hydrogène peuvent former des structures polyatomiques que l’on nomme « complexes ».
Les hydrures complexes les plus intéressants pour stocker l'hydrogène sont les tétrahydruroborates M(BH4) et les tétrahydruroaluminates ou alanates M(AlH4). Pour avoir un rapport massique entre l’hydrogène stocké et la masse totale du composé « stockant » le plus élevé possible, M représente souvent le lithium ou le sodium (LiBH4, NaBH4, LiAlH4, NaAlH4).
À ce jour, le composé LiBH4 possède la plus grande densité massique d’hydrogène (18 %). La cinétique de stockage est longtemps restée assez défavorable (pour les conditions de température notamment), mais une forme plus instable de ce composé a été trouvée en 2007, qui nécessite cependant une pression extrême pour être synthétisée (200 000 atmosphères, mais la structure commence à apparaitre dès 10 000 atmosphères ; pression actuellement utilisée par l'industrie pharmaceutique pour comprimer les pilules »[30]).
Dans ces hydrures complexes, l’hydrogène occupe les sommets d’un tétraèdre dont le centre est occupé par un atome d’aluminium ou de bore. Ces tétraèdres portent une charge négative qui est compensée par la charge positive des cations Li+ ou Na+.
Les principes du stockage et de la libération d’hydrogène sont différents dans le cas des hydrures complexes de ce qu’ils sont pour les hydrures métalliques. En effet, le stockage s’effectue pour les premiers lors d’une réaction chimique et non pas par « simple » occupation des « vides » de la structure comme dans le cas des hydrures métalliques. Pour l'alanate de sodium, le mécanisme de libération de l’hydrogène est :
- 6 NaAlH4 ⟶ 2 Na3AlH6 + 4 Al + 6 H2 ⟶ 6 NaH + 6 Al + 9 H2
Jusqu’à la fin des années 90 et l’utilisation de catalyseurs à base de titane[Note 4], la réaction inverse c'est-à-dire de stockage de l’hydrogène n’était pas possible dans des conditions modérées. Cette découverte permet d'envisager leur utilisation pour le stockage d'hydrogène des applications mobiles : une trentaine de kilogrammes d’hydrures complexes suffirait en effet à héberger les 4 kg d'hydrogène déjà évoqués.
Acide formique[modifier | modifier le code]
En 2006, une équipe de recherche de l’EPFL (Suisse) a présenté l'utilisation de l'acide formique comme solution de stockage de l’hydrogène[31]. Un système catalytique homogène, basé sur une solution aqueuse de catalyseurs au ruthénium décompose l'acide formique (HCOOH) en dihydrogène H2 et dioxyde de carbone (CO2)[32]. Le dihydrogène peut être ainsi produit dans une large plage de pression (1 – 600 bars) et la réaction ne génère pas de monoxyde de carbone. Ce système catalytique résout les problèmes des catalyseurs existants pour la décomposition de l'acide formique (faible stabilité, durée de vie des catalyseurs limitée, formation de monoxyde de carbone) et viabilise cette méthode de stockage d'hydrogène[33].
Le coproduit de cette décomposition, le dioxyde de carbone, peut être utilisé dans un deuxième temps pour générer à nouveau de l’acide formique par hydrogénation. L'hydrogénation catalytique du CO2 a été longuement étudiée et des méthodes efficaces ont été développées[34],[35].
L'acide formique contient 53 g/L d'hydrogène à température et pression ambiante, ce qui représente deux fois la densité énergétique de l’hydrogène compressé à 350 bars. Pur, l'acide formique est un liquide inflammable à +69 °C, ce qui est supérieur à l’essence (−40 °C) ou l'éthanol (+13 °C). Dilué dès 85 %, il n'est plus inflammable. L'acide formique dilué est même inscrit sur la liste des additifs alimentaires de l'administration américaine des denrées alimentaires et des médicaments (FDA)[36].
Autres hydrures, amino-boranes…[modifier | modifier le code]
D'autres types d'hydrures peuvent être envisagés. Par exemple la famille des amino-boranes (NHxBHx) constitue une voie prometteuse puisque ces derniers peuvent théoriquement absorber plus de 20 % en masse. Le composé NH4BH4 peut absorber 24,5 % en masse mais il est instable au-dessus de −20 °C ce qui le rend peu pratique. Par contre le composé NH3BH3 (20 %) est stable dans les conditions normales et nécessite des températures modérées pour relâcher l'hydrogène, ce qui le rend potentiellement plus intéressant[37],[38].
Platine[modifier | modifier le code]
Une éponge de platine peut condenser dans ses pores jusqu'à 743 fois son volume d'hydrogène [39].
Éponges macro-moléculaires et cristallines[modifier | modifier le code]
Différentes structures macromoléculaires et cristallines sont évaluées pour absorber l'hydrogène (avec parfois une composante d'adsorption). Elles permettraient en effet un stockage de l’Hydrogène « piégé » sous forme de poudre, plus stable, compact, moins onéreux… Mais d'importantes recherches restent à faire pour améliorer la capacité d’absorption, et le contrôle du relargage de l'hydrogène.
Les fullerènes permettrait d’atteindre des densités d’hydrogène stocké approchant celles du cœur de Jupiter. Par exemple le buckminsterfullerène (60 atomes de carbone) peut stocker de 23 à 25 molécules d’hydrogène[40][source insuffisante]. Par des simulations numériques, il est montré qu'une seule molécule en C60 pourrait absorber jusqu’à 58 molécules d’hydrogène, en raison de liaisons covalentes qui se forment entre atomes de carbone au-delà des 20 molécules d’hydrogène.
En conclusion, le stockage moléculaire semble très intéressant et avantageux. Toutefois, le moyen d’ "injecter" et de "libérer" avec une bonne efficacité les molécules d’hydrogène des fullerènes reste encore à trouver, c'est-à-dire que les techniques n'en sont encore qu'aux prémices, bien loin du stade de la production industrielle.
Stockage par conversion en ammoniac[modifier | modifier le code]
L'ammoniac (NH3) à l'état liquide contient plus d'atomes d’hydrogène pour un volume donné que le dihydrogène liquéfié. Le rendement énergétique de la synthèse de NH3 par le procédé Haber-Bosch à partir de dihydrogène et du diazote atmosphérique est de l’ordre de 70 %[41]. Sa densité énergétique est de 6,5 kWh/kg, ce qui est moitié moindre que le pétrole mais le rend envisageable pour une utilisation à bas coût dans des applications mobiles. L'ammoniaque, solution du premier, se stocke sous forme liquide dans des gazomètres réfrigérés à −28 °C à pression atmosphérique ; le transport peut s'effectuer également sous pression de 10 bars à température ambiante[41],[42].
Utilisation[modifier | modifier le code]
On peut utiliser l'ammoniac comme source d'énergie :
- soit en pile à combustible, où il réagit avec le dioxygène de l'air. NH3 est alors entièrement dissocié en eau et diazote. Le rendement pour de l'ammoniac pur atteint 70 % à une température de 800 °C, avec des émissions très faibles de NOx. En 2013, des prototypes de pile à combustible à céramique protonante (PCFC) de 500 W et 1 kW alimentées par NH3 sont en développement[41] ;
- soit sous forme d'hydrogène, en le décomposant par craquage à haute température (400 à 800 °C) catalysé par un métal (Ni–Ru par exemple), pour ainsi récupérer du dihydrogène et du diazote. L'ammoniac est alors un moyen de stockage et de transport de l'hydrogène, dont l'efficacité est élevée (99,99 % de NH3 dissocié) et le coût abordable[43].
Comme solution de stockage d'énergie, il peut représenter une alternative à l'hydrogène, les conditions nécessaires étant comparables à celles des hydrocarbures gazeux ou liquides. Il pourrait alors être stocké en volume suffisant pour adapter une production intermittente et saisonnière aux besoins fluctuants de la consommation[41], avec un rendement de production (évoqué plus haut) de 70 %.
Risques[modifier | modifier le code]
Le principal danger est sa toxicité : une exposition de quelques minutes à 10 000 ppm peut être mortelle[44]. En revanche, l’ammoniac est très peu inflammable ; les précautions à prendre pour un véhicule alimenté en NH3 sont comparables à celles du GPL[41]. En cas de combustion, la production d'oxydes d'azote peut cependant s'avérer toxique si les conditions ne sont pas contrôlées[41]. Toutefois, l’ammoniac est facilement détectable du fait de son odeur suffocante : le seuil de perception est de l’ordre de 1 à 50 ppm.
Stockage en station[modifier | modifier le code]
Si le stockage mobile pose encore de nombreux problèmes, le stockage local dans des réservoirs est possible avec les technologies disponibles[45] :
- hydrogène comprimé stocké sous pression dans un « réservoir d'hydrogène » ;
- hydrogène liquéfié en réservoir cryogénique.
Stockage géologique souterrain[modifier | modifier le code]
Ce mode de stockage a été envisagé, testé et utilisé en cavités salines profondes (dômes de sel) ; il a aussi été envisagé dans d'anciens champs pétro-gaziers épuisés. Il peut s'insérer dans une approche en réseau (stockage d'énergie de réseau) et dans un bouquet énergétique. En termes d'efficacité énergétique, le rapport entre l'énergie utilisée pour le stockage et l'énergie récupérable est d'environ 40 % (contre 78 % pour le stockage hydroélectrique), mais le coût reste légèrement supérieur à celui du pompage-turbinage[46].
Stockage en cavités salines[modifier | modifier le code]
En 2022, il existe 4 sites de ce type (3 aux États-Unis et 1 au Royaume-Uni, le plus anciens, en fonction depuis les années 1970. Ils n'ont jamais signalé d'accident ni de problème majeur selon le BRGM, ICI et Storengy)[47]. En France, deux projets, modestes, sont en 2022 à l'étude, portés par le BRGM, HDF (Hydrogène de France) et Teréga à Carresse-Cassaber pour stocker de l'hydrogène vert (issu d'électricité d'origine solaire et éolienne) :
- HyPSTER, un projet européen basé à Étrez dans le département de l'Ain. Storengy (filiale d'Engie) va, à partir de juin 2022, y convertir un ancien site de stockage de gaz naturel (-800 m), en stockage de 44 tonnes d’hydrogène (8 000 m³). « L’injection et le soutirage de l’hydrogène vont se faire avec un cyclage élevé, en fonction de la variabilité de la production d’électricité. On va étudier les aspects technico-économiques d’une telle configuration, avec 100 cyclages en trois mois »[48] ;
- « Hygéo », autre projet de Storengy, est en phase de pré-faisabilité en 2022, dans les Pyrénées-Atlantiques, pour stocker, à -700m, de l'Hydrogène dans une cavité d'environ 30 m de hauteur et 40M de large à sa base (de quoi stocker environ stocker 1,5 GWh d’énergie, soit la consommation annuelle de 400 foyers environ). Cette cavité est un ancien stockage de saumure, fermé vers 2015 et n'ayant jamais accueilli d’hydrocarbures[49].
Stockage en pipe-line[modifier | modifier le code]
Le réseau de distribution de gaz naturel existant est également approprié pour le stockage d'hydrogène.
Avant de passer au gaz naturel, les réseaux de gaz allemands utilisaient du gaz de ville, composé en partie d'hydrogène. Le réseau de gaz de l'UE-27 est d'environ 79 GNm3/an, soit une capacité de 27 GW pour le gaz naturel[réf. souhaitée].
La capacité actuelle de stockage du réseau de gaz naturel allemand est plus de 200 TWh ce qui est suffisant pour plusieurs mois de besoins en énergie. Par comparaison, la capacité de toutes les centrales de stockage allemands par pompage-turbinage s'élève à seulement environ 40 GWh. En outre, le transport du vecteur énergétique gazeux via le réseau de gaz se fait avec beaucoup moins de pertes (< 0,1 %) par rapport à un réseau de distribution électrique (environ 8 %).
L'utilisation du système existant de gaz naturel pour l'hydrogène en Allemagne a été étudiée par le projet européen NaturalHy.
Recherche[modifier | modifier le code]
La recherche est active dans de nombreux pays et pourrait aussi faire progresser le stockage de l'hélium. Les travaux de laboratoires et les essais de constructeurs portent notamment sur l'élaboration de réservoirs en polymères à la fois légers, très étanches et ne se dégradant pas au contact de l'hydrogène.
En Europe, le projet StorHy (« Système de stockage d'hydrogène pour des applications automobiles ») a été lancé en 2004 pour accélérer les progrès dans le stockage gazeux sous haute pression (jusqu'à 700 bar), stockage sous forme liquide (cryogénique, à -253 °C) et stockage par absorption.
Notes et références[modifier | modifier le code]
Notes[modifier | modifier le code]
- C'est-à-dire à pression atmosphérique et 0 °C.
- L'adsorption désigne le phénomène par lequel un composé (ex. : l’hydrogène) est « accroché » à la surface d’un autre ; l'absorption, celui où il est « accroché » à l’intérieur d’un autre composé. On parle de « sorption » quand on ne veut pas distinguer les deux modes et de « désorption » quand l’hydrogène est « relâché » de son support.
- Il existe en général une relation inverse entre la capacité d’un alliage à absorber l’hydrogène et sa capacité à le relâcher ; plus il est facile d’absorber, plus il est difficile de désorber l’hydrogène.
- La manière dont le titane agit comme promoteur est encore discutée. Peut-être n'est-il pas vraiment un catalyseur, car il semble changer d'état entre le début et la fin de la réaction. Le terme de « dopant » est parfois alors utilisé.
Références[modifier | modifier le code]
- « « Révolution de l’hydrogène » : c'est possible ? », Planète énergies (Total), (consulté le ).
- CEA (2012), Distribution et stockage de l'hydrogène (4/6), in dossier Les énergies renouvelables ; l'hydrogène.
- « L’hydrogène est plus dangereux que les carburants traditionnels », sur Connaissance des énergies, (consulté le ).
- (en) Egon Wiberg, Nils Wiberg et Arnold Frederick Holleman, Inorganic chemistry, Academic Press, (ISBN 978-0123526519, lire en ligne), p. 240.
- « Le stockage d'énergie sous forme d'hydrogène solide », sur connaissancedesenergies.org, (consulté le )
- (en) Sofoklis Makridis, chap. 1 « Hydrogen storage and compression », dans Rupp Carriveau et David S-K. Ting, Methane and hydrogen for energy storage, , 176 p. (ISBN 9781785611933 et 9781785611940, DOI 10.1049/PBPO101E_ch1, présentation en ligne, lire en ligne), p. 1–28.
- Hycan à la SaintéLyon
- Chargeur USB à hydrogène.
- Rachida Boughriet, Le CEA et ses partenaires finalisent un réservoir de stockage d'hydrogène sous pression pour l'automobile, Actu Environnement, le 21 novembre 2008.
- Dominique Perreux, « Le stockage d'hydrogène, un défi scientifique et technologique », Institut FEMTO-ST, département LMARC, En direct, n°188, octobre 2004, Université de Franche-Comté.
- Honda Clarity
- Nissan
- Mercedes Class B.
- (en) « Hydrogen », sur Gas Encyclopedia Air Liquide, (consulté le ).
- https://www.energy.gov/eere/fuelcells/articles/oem-perspective-cryogenic-h2-storage
- Hydrogen Storage
- (en) System Level Analysis of Hydrogen Storage Options, Département de l'Énergie des États-Unis, juin 2010 [PDF], diapositive 6.
- http://www.hydrogen.energy.gov/pdfs/review10/st002_lasher_2010_o_web.pdf
- Dr. Oliver Kircher (2010), Advances in Cryo-compressed Hydrogen Vehicle Storage (CcH2), BMW Group, et document pdf
- (en) L. J. Florusse, C. J. Peters, J. Schoonman, K. C. Hester, C. A. Koh, S. F. Dec, K. N.Marsh, and E. D. Sloan, Stable Low-Pressure Hydrogen Clusters Stored in a BinaryClathrate Hydrate. Science 2004; 306 (5695), 469.
- (en) T. Kawamura, M. Ohtake, Y. Yamamoto, and S. Higuchi, Hydrogen absorptionbehavior of organic-compound clathrate hydrates. Proceedings of the 6th InternationalConference on Gas Hydrates (ICGH) 2008;
- (en) T. A. Strobel, C. A. Koh, and E. D. Sloan, Hydrogen storage properties of clathratehydrate materials. Fluid Phase Equilib. 2007; 261, 382–389
- Carine Seghier, « Les nanocornets de carbone potentiellement efficaces pour stocker l'hydrogène », sur actu environnement, (consulté le ).
- Les liaisons hydrogène ne sont pas considérées ici.
- « Stockage de l’hydrogène dans le magnésium »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), CNRS / Institut Néel.
- Reservoirs Mc-Phy
- « Stockage d’hydrogène solide », sur MAHYTEC (consulté le )
- « Stocker de l'hydrogène sans créer de bombes : McPhy prend du magnésium », L'Usine nouvelle, (consulté le ).
- Jean-François Preveraud, « Des nanotechnologies pour faciliter le stockage solide de l’hydrogène », sur industrie techno, (consulté le )
- Jean-Luc Goudet (2007), Stockage d’hydrogène : un bon candidat découvert à Grenoble, Futura science
- Gábor Laurenczy, Céline Fellay, Paul J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- Céline Fellay, Paul J. Dyson, Gábor Laurenczy, A Viable Hydrogen-Storage System Based On Selective Formic Acid Decomposition with a Ruthenium Catalyst, Angew. Chem. Int. Ed., 2008, 47, 3966–3970.
- Ferenc Joó, Breakthroughs in Hydrogen Storage – Formic Acid as a Sustainable Storage Material for Hydrogen, ChemSusChem 2008, 1, 805–808.
- P. G. Jessop, in Handbook of Homogeneous Hydrogenation (Eds.: J. G. de Vries, C. J. Elsevier), Wiley-VCH, Weinheim, Germany, 2007, pp. 489–511.
- P. G. Jessop, F. Joó, C.-C. Tai, Recent advances in the homogeneous hydrogenation of carbon dioxide, Coord. Chem. Rev., 2004, 248, 2425–2442.
- US Code of Federal Regulations: 21 CFR 186.1316, 21 CFR 172.515
- (en) A. Raissi, Hydrogen Storage in Ammonia and Aminoborane Complexes [PDF].
- (en) Enhancement of the Hydrogen Storage Properties of Ammonia Borane in the MicroNano Pores of Mesoporous Silica [PDF].
- Encyclographie des sciences médicales, Volumes 22 à 24.
- Stockage de l'Hydrogène, TPE La pile à hydrogène, 2009.
- « Stockage de l’énergie via l’ammoniac », sur Enerzine (consulté le ).
- « ammoniac », Encyclopædia Universalis (consulté le ).
- (en) Gottfried Faleschini, Viktor Hacker, Markus Muhr, Karl Kordesch, Robert Raymond Aronsson, « Ammonia for High Density Hydrogen Storage », Fuel Cell Seminar, Portland, , p. 336-339.
- (en) Thomas McSweeney et John Holbrook, « Ammonia Safety » (présentation), Ammonia, the Key to US Energy Independence, , p. 35 (lire en ligne [PDF], consulté le ).
- EERE R&D of large stationary hydrogen/CNG/HCNG storage vessels
- Parlement européen (2012) European Renewable Energy Network, p. 86, 189.
- 1994 – ECN abstract, Hyweb.de (consulté le ).
- Stéphane Signoret, « Comment stocker l’hydrogène sous terre », sur Techniques de l'Ingénieur, (consulté le )
- Nicolas Louis, « Une seconde cavité saline expérimentée pour stocker de l'hydrogène en France », sur Techniques de l'Ingénieur, (consulté le )
Sources[modifier | modifier le code]
- Généralités
- (en) L. Schlapbach et A. Züttel, « Hydrogen-storage materials for mobile applications », Nature, vol. 414, , p. 353-358 (lire en ligne [PDF], consulté le )
- (en) Sunita Satyapal, John Petrovic et George Thomas, « Gassing Up with Hydrogen », Scientific American,
- (it) Sunita Satyapal, John Petrovic et George Thomas, « Fare il pieno di idrogeno : Le tecnologie per immagazzinare l'idrogeno e garantire un'ampia autonomia non sono mature, ma ci sono incoraggianti prospettive », Le Scienze, no 468, , p. 96-103
- Hydrures
- (en) Wojciech Grochala et Peter P. Edwards, « Thermal Decomposition of the Non-Interstitial Hydrides for the Storage and Production of Hydrogen », Chemical Reviews, vol. 104, no 3, , p. 1283-1316 (DOI 10.1021/cr030691s)
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Jeremy Rifkin (2002) L'économie hydrogène : après la fin du pétrole, la nouvelle révolution économique , La Découverte,
- Rapport Filière hydrogène-énergie [PDF] (rapport n° 010177-01), co-écrit par Jean-Louis Durville, Jean-Claude Gazeau, Jean-Michel Nataf, CGEDD, Jean Cueugniet, Benoît Legait, CGE, 161 p. rendu public le (résumé)
- Louis Londe, « Filière hydrogène : un destin souterrain », Pour la science, no 553, , p. 32–39 (ISSN 0153-4092, lire en ligne, consulté le ).
Articles connexes[modifier | modifier le code]
Généralités en lien avec le sujet
De premiers véhicules à hydrogène
- BMW Hydrogen 7 : véhicule pouvant fonctionner avec de l'hydrogène liquide (projet abandonné)
- Honda FCX Clarity : véhicule hybride à pile à hydrogène
- Fiat Panda II H2 : véhicule prototype hybride à pile à hydrogène
Liens externes[modifier | modifier le code]
- Base de données sur les propriétés thermodynamiques des hydrures métalliques
- MaHyTec MAHYTEC Société spécialisée dans le stockage d'hydrogène haute pression et stockage solide sous hydrures
- Bahya première tondeuse autoportée fonctionnant à hydrogène.
- Projets cofinancés par l'Union européenne
- projet HyFLEET:CUTE: suivi de bus pour le transport public fonctionnant à l'hydrogène (en)
- (fr + en + de + it + es) projet Hychain: flotte de véhicules de faibles puissances utilisant l'hydrogène comme carburant
- projet Zero Regio: mise en place dans deux régions allemandes et italiennes d'infrastructures pour l'utilisation d'hydrogène dans les transports (en + de + it)
- h2moves.eu autres projets en Europe (en)
- Projet Mobypost développement de petits véhicules pour la Poste utilisant l'hydrogène comme carburant, hydrogène stocké à basse pression dans des réservoirs solides
- Projets cofinancés par le Fonds unique interministériel (France)
- projet HyCan Petits stockages d'hydrogène pour applications nomades ou ultra-mobiles,
- (fr + en) Portail canadien de l'économie basée sur l'hydrogène

