Séparation par micro extraction
La séparation par micro extraction (SPME) est une technique analytique fondée sur l'adsorption de molécule sur une fibre de silice greffée, immergée dans la solution contenant les molécules à caractériser. Le greffage de la fibre peut avoir différentes caractéristiques et polarité, si bien que celle-ci aura une affinité différente vis-à-vis des molécules organiques.
L'analyse d'une molécule organique, souvent réalisée en chromatographie de partage nécessite la concentration des molécules de l'ordre du ng.ml−1 ainsi qu'une mise en solution en phase éluante (HPLC-acetnitrile ou méthanol), ou dans un solvant organique (par exemple acétate d’éthyle, alcanes…), le transfert de la phase aqueuse (eau polluée) se faisant par partage dans un solvant dit "d'extraction", par extraction fractionnée, celui-ci étant souvent chloré. Les volumes ainsi utilisés sont de l'ordre de 100 à 200 ml, et sont souvent rejetés en atmosphère libre par évaporation sous courant d'azote. L'impact des produits chlorés, COV majeurs n'est plus à démontrer. Plusieurs techniques existent actuellement pour éviter l'utilisation de ces solvants, la SPE 'séparation par extraction" par filtration de l'eau sur un disque adsorbant les molécules organiques, avec une phase de désorption/élution avec un solvant organique, ou la S.P.M.E, séparation par micro extraction, n'utilisant aucun solvant.
Les fibres de type PDMS (poly dimethyl siloxane) vont avoir une affinité pour les molécules apolaires (hydrocarbure aliphatiques, fractions pétrolières, hydrocarbures aromatiques et polyaromatiques), les fibres plutôt polaires auront une affinité pour des composés de type esters, acides carbolyliques, alcools, aldéhydes, cétones, amines…
L'adsorption est un phénomène physique fondé sur plusieurs types d’interactions moléculaires. Les interactions apolaires sont mises en jeu par les forces de "London". Les interactions polaires sont mises en jeu par les forces de type "Debye" et "Keesom". Le phénomène d'adsorption est réversible. La transformation est de type exothermique ou exo-énergétique (la transformation cède de l'énergie ou de la chaleur au milieu).
La désorption des molécules se fait par chauffage de la fibre dans un injecteur de chromatographie, la désorption étant une transformation endothermique. Ainsi l'adsorption peut s'apparenter à la condensation et la désorption à l'évaporation.
Thermodynamique de l'adsorption appliquée à la SPME[modifier | modifier le code]
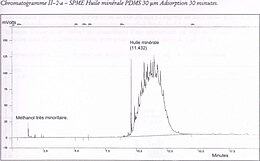
Considérant une solution d'huile minérale dans l'eau, en présence de méthanol, les molécules de la fraction huile minérale se trouvent en équilibre en partage entre la fibre et l'eau. Le coefficient de partage est défini comme étant le rapport des concentrations en masse des molécules ou "soluté" entre le polymère de la fibre et l'eau : Kf,e=[M]fibre/[M]eau ou [M] est la concentration volumique en molécules. Si m est la masse adsorbée sur la fibre, Ve le volume d'eau dans le récipient, Vf le volume de polymère de la fibre, C0 la concentration initiale de l'eau avant mise en contact de la fibre, Ce∞ la concentration finale de l'eau à l'équilibre thermodynamique, Cf∞ la concentration finale du soluté sur la fibre à l'équilibre thermodynamique, le coefficient de partage Kf,e=Cf∞/Ce∞ <1>, la masse de départ est C0.Ve=(Cf∞.Vf) + (Ce∞.Ve)<2>, la masse adsorbée sur la fibre étant Cf∞.Vf <3>, en combinant <1><2><3> la masse adsorbée est: M=(C0.Ve.Vf.Kf,e)/[(Kf,e.Vf)+Ve] <4>
Si le volume d'échantillon d'eau est très grand devant celui de la fibre l'expression <4> tend vers : M=C0.Vf.Kf,e On peut en déduire que, pour un volume d'eau suffisant, il existera une relation affine entre la concentration de départ C0, et la quantité de molécules adsorbée sur la fibre, il serait donc possible de faire un "dosage" par adsorption/désorption chromatographique.
Changement d’agrégation, transformation exo-énergétique[modifier | modifier le code]
En principe, le potentiel énergétique des molécules est plus bas à l'état adsorbé, qu'en suspension libre dans l'eau. Les molécules en suspension dans l'eau sont dans un état plus désordonné, qu'à l'état condensé sur la fibre, l'entropie à l'état libre ou la mesure du "désordre" sera plus élevée en suspension dans le liquide, à l'état dispersé et sous agitations. La variation d'entropie molaire de référence sera négative, comme pour tout phénomène de condensation. Pour une transformation isobare et monotherme, si la transformation est spontanée, la variation d'enthalpie libre, ou énergie de GIBBS, sera alors négative. Soit M le mélange d'alcane, (M,e) ce mélange en suspension dans l'eau et (M,f) à l’état agrégé sur le polymère, la variation d'enthalpie libre molaire de référence du processus est : H0m(M,f)-H0m(M,e)=ΔH0m La variation d'entropie molaire de référence sera : S0m(M,f)-S0m(M,e)=ΔS0m adsorption, qui sera négative, car l’état agrégé des gouttelettes d'huile est plus ordonné sur la fibre que dans l'eau à l'état libre et dispersé. La variation d’enthalpie libre ΔG0m adsorption=ΔH0m-TΔS0m et pour une température telle que Te<dHt,p/dSt,p la transformation sera alors spontanée. À l'équilibre, comme pour tout système, on aura dGt,p=0 l’énergie sera minimale et ne variera plus.
Enthalpie libre et potentiel énergétique[modifier | modifier le code]
La relation de "GIBBS HELMOTZ" permet de calculer la variation d’enthalpie H si on connait G et le coefficient de température : Elle peut être mise sous une autre forme : ∂/∂T[G/T]p=-H/T2
La variation d’enthalpie libre avec la pression pour un gaz supposé parfait est : dG=VdP et PV=nRT, d’où dG=nRT.dP/T=nRTd(Lnp), ou dG représente l’excès d’énergie libre d'une molécule de gaz parfait à la pression Pi et température T, par rapport à son énergie libre dans les conditions normales de température et de pression P0=1atm. Soit Gi-G0i=RTLnPi
Potentiel chimique, état non parfait et notion de fugacité[modifier | modifier le code]
Il est défini la notion de potentiel chimique qui conduit à une théorie plus générale des équilibres pour les phases hétérogènes et condensées, il est nécessaire d'introduire la variable n, ou nombre de molécules grammes de constituant i car la composition du système change tant que celui-ci n'est pas en équilibre : le potentiel chimique (GIBBS) noté μi=(∂G/∂ni)p,v,t,nj cette relation exprime la variation du potentiel énergétique en fonction de celle du nombre de mol de constituant ni de i, à T et P constante, tous les autres constituants j du système étant invariants en nombre de mol.
Pour un gaz parfait, le potentiel énergétique est simplement le potentiel thermodynamique par mol à la pression Pi soit μi-μ0i = RT LnPi La valeur μ0i pour un gaz parfait sera la même, pour la gaz pur à la pression Pi, ou dans un mélange de gaz ou sa pression partielle sera Pi, car les molécules de gaz sont très éloignées les unes des autres, on peut considérer qu'il n'y a pas d'interactions entre elles. Dans un état aussi condensé que sur la fibre, très loin de l’état parfait, cette approximation n'est plus valable est il est introduit la notion de fugacité, homologue de la pression. La fugacité d'un élément exprime sa tendance à quitter le milieu, pour un solvant volatil dans un liquide non volatil, la tendance du solvant volatil à s'échapper du liquide vers la phase vapeur au-dessus du liquide, si on rapproche de l’état parfait, serait la pression de vapeur saturante.
Potentiel chimique en fonction de la fugacité[modifier | modifier le code]
À température constante, on a alors : f0i = 1 et μi-μ0i = RT Lnfi <5> La fraction molaire peut être reliée à la fugacité : Xαi=nαi/nαj Le physicien Henry en 1903 formule l'expression qui relie pression partielle d'un constituant à sa fraction molaire, pi=K.Xi Mais pour des composés plus lourds, mieux vaut passer par la loi en solution idéale, hypothèse de Raoult en 1886 pour les liquides et les sels : pi=p0iXi
L'idée de la tension de vapeur au-dessus du liquide est directement représentative de ce qui se passe en solution, de la tendance des molécules à s'échapper de celle-ci. Si on préfère éviter de formuler l'hypothèse des gaz parfaits, on peut exprimer la différence de potentiel thermodynamique en fonction de la fugacité : fi-f0i = RT LnXi <5>
Potentiel chimique et constante d'équilibre[modifier | modifier le code]
Considérant le système fibre/huile minérale/eau :
[HM]eau ↔ [HM]fibre
À l'équilibre : Keq=[HM]fibre/[HM]eau ou keq=XfibreHM/XeauHM
On peut considérer en très bonne approximation que Xfibre HM=1 (l'huile est le seul constituant de la fibre) d’où Keq=1/XeauHM
En utilisant l'expression <5> reliant fugacité et fraction molaire, on peut exprimer le potentiel de l'huile minérale dans l'eau et la fibre à l'équilibre :
μ(HM,eau) = μ0(HM,eau) + RTLn XeauHM et μ(HM,fibre) = μ0(HM,fibre) + RTLn XfibreHM
À l’équilibre on a μ(HM,eau) = μ(HM,fibre), et si l'huile est le seul constituant, on tire : μ0(HM,fibre)-μ0(HM,eau)=G0(HM,fibre)-G0(HM,eau)<0
L'expression de la variation d’enthalpie libre de référence pour le phénomène d'adsorption sur la fibre : ΔG0(eau>fibre)=RTLnXeauHM
Cette relation est l'expression générale des équilibres physico-chimiques reliant constante d'équilibre et variation d'enthalpie libre.
Notes et références[modifier | modifier le code]
- Chromatographie et physisorption - Mémoire d'étude - 3e cycle universitaire
- Chimie physique - Walter J.MOORE - Indiana university DUNOD PARIS 1962 traduction autorisée par Prentice Hall, INC (2e edition 1955) New york
- Chimie analytique Douglas A.SKOOG - Donald M.WEST - James HOLLER - De boeck Université Sunders collège publishing
