Réaction de déshydratation
En chimie, une réaction de déshydratation est une réaction chimique dans laquelle le réactif de départ perd un atome d'hydrogène et un groupe hydroxyle, soit une molécule d'eau, l'inverse de la réaction d'hydratation. Les réactions de déshydratation sont une sous-catégorie des réactions d'élimination. Dans les cellules, et plus particulièrement lors de la β-oxydation des acides gras et de la glycolyse, les réactions de déshydratation sont catalysées par des enzymes appelées « déshydratases ».
Le groupe hydroxyle (–OH) étant un mauvais groupe partant, avoir un acide de Brønsted comme catalyseur favorise la protonation du groupe, le transformant en –OH2+, meilleur groupe partant. Des agents de déshydratation couramment utilisés en synthèse organique sont l'acide sulfurique concentré, l'acide phosphorique concentré, l'oxyde d'aluminium à chaud, et la céramique à chaud.
Une réaction de condensation peut parfois relâcher comme produit une molécule d'eau. On parle alors parfois de synthèse par déshydratation. C'est par exemple le cas pour deux monosaccharides, tels que le glucose ou le fructose, qui peuvent se condenser en un disaccharide (le saccharose) via une synthèse par déshydratation. La réaction inverse est alors une hydrolyse, l'eau se recombinant avec les deux groupes hydroxyle, le disaccharide étant reconverti en deux monosaccharides.
Exemples[modifier | modifier le code]
En synthèse organique, il existe de nombreux exemples de réaction de déshydratation, par exemple la déshydratation des alcools ou des sucres.
| Réactions de déshydratation | ||
| Réaction | Équation | Exemple(s) |
|---|---|---|
| Conversion d'alcools en éthers | 2 R-OH → R-O-R + H2O | |
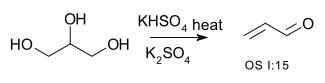
| Conversion d'alcools en alcènes | R-CH2-CHOH-R → R-CH=CH-R + H2O | par exemple, conversion du glycérol en acroléine[1] :
ou la déshydratation du 2-méthyl-1-cyclohexanol en (principalement) 1-méthylcyclohexène[2] : |
| Conversion d'acides carboxyliques en anhydrides d'acide | 2 RCOOH → (RCO)2O + H2O | |
| Conversion d'amides en nitriles | RCONH2 → R-CN + H2O | |
| Réarrangement diénol-benzene | 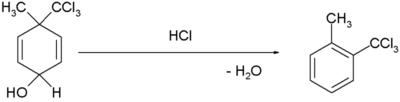 [3],[4] [3],[4]
| |
Notes et références[modifier | modifier le code]
- Organic syntheses OS I:15 Link.
- Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment J. Brent Friesen and Robert Schretzman J. Chem. Educ., 2011, 88 (8), pp 1141–1147 DOI 10.1021/ed900049b.
- H. Plieninger and Gunda Keilich, « Die Dienol-Benzol-Umlagerung », Angew. Chem., vol. 68, no 19, , p. 618–618 (DOI 10.1002/ange.19560681914).
- Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog, and E. B. Hershberg, « The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione », J. Am. Chem. Soc., vol. 80, no 14, , p. 3702–3705 (DOI 10.1021/ja01547a058).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dehydration reaction » (voir la liste des auteurs).