Rifamycine
Une rifamycine est un antibiotique de la famille des ansamycines. Ces molécules sont produites naturellement par Amycolatopsis mediterranei, la bactérie à partir de laquelle elles ont été isolées, ou produites artificiellement. Elles sont particulièrement efficaces contre les mycobactéries et ont de ce fait été utilisées dans des traitements contre la tuberculose, la lèpre et les infections au complexe Mycobacterium avium (en) (MAC). Le groupe des rifamycines comprend les médicaments classiques à rifamycine ainsi que les dérivés de rifamycine : rifampicine (ou rifampine), la rifabutine, la rifapentine et le rifalazil.
Découverte et commercialisation[modifier | modifier le code]
Amycolatopsis mediterranei a été isolée en 1957 à partir d'un échantillon de sol provenant de la région de Saint-Raphaël sur la Côte d'Azur. Cette bactérie a été nommée Streptomyces mediterranei par deux microbiologistes, l'Italienne Grazia Beretta et l'Israélien Pinhas Margalith, du groupe pharmaceutique italien Lepetit SpA à Milan[1]. Les premières rifamycines ont été isolées la même année à partir d'une culture par fermentation de cette bactérie au laboratoire Lepetit à Milan par deux chercheurs italiens, Piero Sensi et Maria Teresa Timbal, en collaboration avec Pinhas Margalith. Sept rifamycines ont été découvertes, appelées rifamycine A, B, C, D, E, S et SV.

La rifamycine B a été la première à être commercialisée. La société Lepetit a déposé une demande de brevet pour cette molécule en août 1958 au Royaume-Uni et en mars 1959 aux États-Unis, donnant lieu respectivement aux brevets GB921045 en mars 1963 et US 3,150,046 en septembre 1964. Il est largement admis que la rifamycine B a contribué à venir à bout de la tuberculose résistante aux médicaments dans les années 1960.
Mode d'action[modifier | modifier le code]
L'activité antibactérienne des rifamycines repose sur l'inhibition de la transcription de l'ADN en ARN en raison de la forte affinité des rifamycines pour l'ARN polymérase des procaryotes[2]. Les données sur des structures cristallisées de rifamycines liées à l'ARN polymérase indiquent que ces antibiotiques bloquent la transcription par occlusion stérique[3],[4], c'est-à-dire en occupant la place nécessaire à l'amorçage de la polymérisation de l'ARN par la polymérase ; si la rifamycine se lie à l'enzyme après que la polymérisation a commencé, celle-ci se poursuit normalement et aucune inhibition n'est observée.
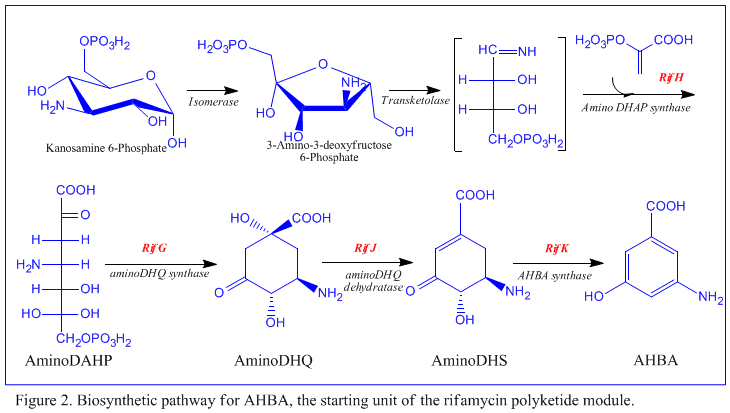
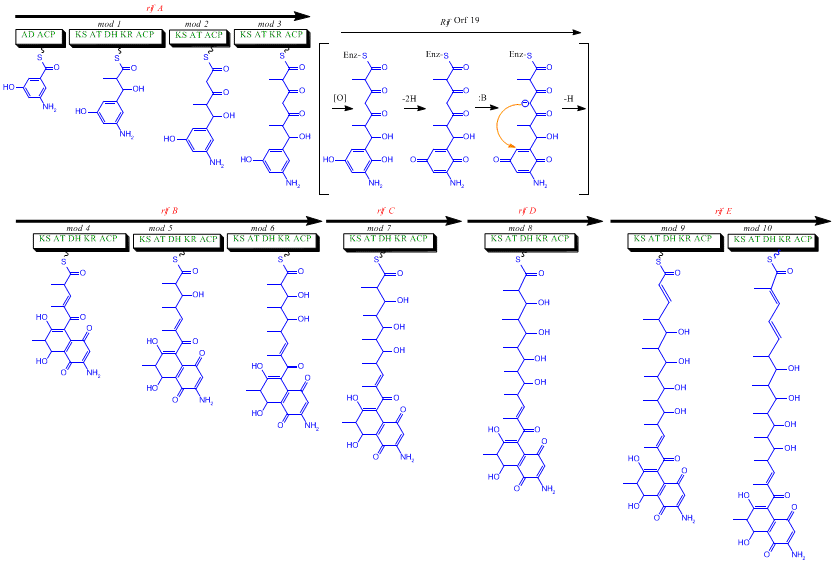
Biosynthèse[modifier | modifier le code]
Bien que la rifamycine B soit un antibactérien doux, c'est le précurseur de plusieurs dérivés plus puissants utilisés en thérapeutique. La biosynthèse de cet antibiotique commence avec une amorce rare, l'acide 3-amino-5-hydroxybenzoïque (AHBA), sur une polycétide synthase de type I qui allonge la chaîne en utilisant deux unités acétate et huit unités propionate[5]. On pense que l'AHBA provient essentiellement du métabolisme du shikimate mais trois analogues d'acides aminés convertis en AHBA ont été observés dans les extraits cellulaires d’A. mediterranei[6].

Notes et références[modifier | modifier le code]
- (en) P. Margalith et G. Beretta, « Rifomycin. XI. taxonomic study on streptomyces mediterranei nov. sp. », Mycopathologia et mycologia applicata, vol. 13, no 4, , p. 321-330 (lire en ligne) DOI 10.1007/BF02089930
- (en) Clara Calvori, Laura Frontali, Louisa Leoni et Giorgio Tecce, « Effect of Rifamycin on Protein Synthesis », Nature, vol. 207, , p. 417-418 (lire en ligne) DOI 10.1038/207417a0
- (en) Elizabeth A. Campbell, Nataliya Korzheva, Arkady Mustaev, Katsuhiko Murakami, Satish Nair, Alex Goldfarb et Seth A. Darst, « Structural Mechanism for Rifampicin Inhibition of Bacterial RNA Polymerase », Cell, vol. 104, no 6, , p. 901-912 (lire en ligne) DOI 10.1016/S0092-8674(01)00286-0
- (en) Andrey Feklistov, Vladimir Mekler, Qiaorong Jiang, Lars F. Westblade, Herbert Irschik, Rolf Jansen, Arkady Mustaev, Seth A. Darst et Richard H. Ebright, « Rifamycins do not function by allosteric modulation of binding of Mg2+ to the RNA polymerase active center », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 39, , p. 14820-14825 (lire en ligne) DOI 10.1073/pnas.0802822105
- (en) Lancini, G.; Cavalleri, B., In Biotechnology of Antibiotics, Marcel Dekker, New York, USA, , p. 521
- (en) Heinz G. Floss et Tin-Wein Yu, « Rifamycin – Mode of Action, Resistance, and Biosynthesis », Chemical Reviews, vol. 105, no 2, , p. 621-632 (lire en ligne) DOI 10.1021/cr030112j
