Réaction de Bucherer
La réaction de Bucherer est une réaction organique réversible qui permet de convertir un naphtol en naphtylamine par réaction avec l'ammoniaque et le bisulfite de sodium[1],[2],[3],[4].
Le chimiste français Robert Lepetit est le premier à avoir découvert cette réaction en 1898, mais c'est le chimiste allemand Hans Theodor Bucherer (1869-1949) qui a découvert (indépendamment de Lepetit) sa réversibilité et son potentiel pour la chimie, en particulier pour l'industrie. Bucherer a publié ses résultats en 1904 et c'est son nom qui est attaché à la réaction. Elle est toutefois parfois aussi nommée réaction de Bucherer-Lepetit.
Mécanisme réactionnel[modifier | modifier le code]
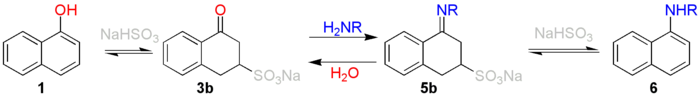
Dans la première étape, l'un des carbones du naphtol, riche en électrons, est protoné avec une préférence pour le carbone 2 ou le carbone 4 (1). Ceci produit l'adduit stabilisé par mésomérie (composés 1a-1e). Cette dé-aromatisation du premier cycle nécessite un apport d'énergie de 25 kcal·mol-1. Dans le seconde étape, un anion bisulfite s'additionne sur le carbone 3 à partir de la forme 1e. Cette addition forme le composé 3a qui se tautomérise en composé 3b, plus stable, qui est le dérivé sulfonique de la tétralone. Ce composé subit ensuite une addition nucléophile par l'ammoniaque ou une amine formant le composé 4a et son tautomère 4b, qui perd alors de l'eau pour former le cation 5a stabilisé par mésomérie. Ce composé est déprotoné en imine 5b ou en énamine 5c, un équilibre existant entre les deux espèces. La forme énamine élimine le bisulfite de sodium pour former la naphtylamine 6.
Il est important de noter que cette réaction est réversible. Le mécanisme réactionnel peut d'ailleurs être résumé comme suivant: :
La synthèse de carbazole de Bucherer est proche de cette réaction.
Notes et références[modifier | modifier le code]
- (de) H. T. Bucherer, « Über die Einwirkung schwefligsaurer Salze auf aromatische Amido- und Hydroxylverbindungen », Journal für praktische Chemie, vol. 69, no 1, , p. 49–91 (ISSN 0941-1216, DOI 10.1002/prac.19040690105).
- (en) H. H. Seeboth, « The Bucherer Reaction and the Preparative Use of its Intermediate Products », Angewandte Chemie Int. Ed., vol. 6, no 4, , p. 307–317 (ISSN 1433-7851, DOI 10.1002/anie.196703071).
- (en) N. L. Drake, Organic Reactions, vol. 1, John Wiley & Sons, , 402 p. (ISBN 978-0-471-00462-2, DOI 10.1002/0471264180.or001.05), chap. 5 (« The Bucherer Reaction »).
- (en) M. B. Smith et J. March, March's advanced organic chemistry : Reactions, mechanisms, and structure, Hoboken, NJ, John Wiley & Sons, , 7e éd., 2080 p. (ISBN 978-0-470-46259-1, présentation en ligne), chap. 13 (« Aromatic Substitution: Nucleophilic and Organometallic »), p. 756.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bucherer reaction » (voir la liste des auteurs).