Prodigiosine
| Prodigiosine | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
La prodigiosine est une pyrrole de formule C20H25N3O, rencontrée dans la nature comme la substance rouge que produisent de nombreuses souches de Serratia marcescens[1],[2], ainsi que d'autres gammaprotéobactéries à Gram négatif telles que Vibrio psychroerythrus et Hahella chejuensis. Elle est responsable de la teinte rose apparaissant dans des dépôts qui se forment sur la porcelaine, mal entretenue, telle que celle des baignoires, éviers ou cuvettes de toilettes. Elle fait partie de la famille des prodiginines que produisent certaines gammaprotéobactéries à Gram négatif, ainsi que certaines actinobactéries à Gram positif (par exemple Streptomyces coelicolor)[3]. Le nom prodigiosine est dérivé de prodigieux (c'est-à-dire quelque chose de merveilleux).
Métabolite secondaire[modifier | modifier le code]
La prodigiosine est un métabolite secondaire de Serratia marcescens. Parce qu'il est facile à détecter, il a été utilisé comme système modèle pour étudier le métabolisme secondaire. On sait depuis longtemps que la production de prodigiosine est améliorée par une limitation en phosphate. En effet, dans des conditions de faible teneur en phosphate, il a été montré que les souches pigmentées croissent à une vitesse plus élevée que les souches non pigmentées[4].
Fonction religieuse[modifier | modifier le code]
La capacité des souches pigmentées de Serratia marcescens à pousser sur du pain a conduit les scientifiques à faire de ce phénomène une explication possible des miracles médiévaux de transsubstantiation, dans le contexte desquels le pain eucharistique est converti en Corps du Christ. De tels miracles ont conduit le pape Urbain IV à instituer la fête du Corpus Christi en 1264. Cela faisait suite à la célébration d'une messe à Bolsena en 1263, dirigée par un prêtre bohémien qui avait des doutes concernant la transsubstantiation[3]. Pendant la messe, l'eucharistie semblait saigner et chaque fois que le prêtre essuyait le sang, il en apparaissait davantage. Cet événement est célébré dans une fresque du Palais pontifical de la Cité du Vatican, peinte par Raphaël[5].
Activité biologique[modifier | modifier le code]
La prodigiosine a reçu un regain d'intérêt[3],[6] du fait de son large éventail d'activités biologiques, telles que des activités antipaludiques[7], antifongiques[8], immunosuppressives[9] et antibiotiques[10]. La fonction pour laquelle elle est la plus connue est peut-être sa capacité à déclencher l'apoptose des cellules cancéreuses malignes. Le mécanisme exact de cette inhibition est très complexe et n'est pas entièrement élucidé, mais pourrait impliquer plusieurs processus, y compris l'inhibition de la phosphatase, le clivage par le cuivre de l'ADN double brin, ou la perturbation du gradient de pH par le transport transmembranaire des ions H+ et Cl−[11]. En conséquence, la prodigiosine est une piste médicamenteuse et est en phase d'étude préclinique pour le traitement du cancer du pancréas[12]. La prodigiosine s'est récemment avérée avoir une excellente activité contre Borrelia burgdorferi en phase stationnaire, l'agent causant la maladie de Lyme[13].
Production[modifier | modifier le code]
Biosynthèse[modifier | modifier le code]
 |
 |
La biosynthèse de la prodigiosine[15],[16] et des analogues apparentés, les prodiginines[3],[14], implique le couplage convergent de trois anneaux de type pyrrole (marqués A, B et C sur la figure 1) à partir de L-proline, L- sérine, L-méthionine, pyruvate et 2-octénal[17].
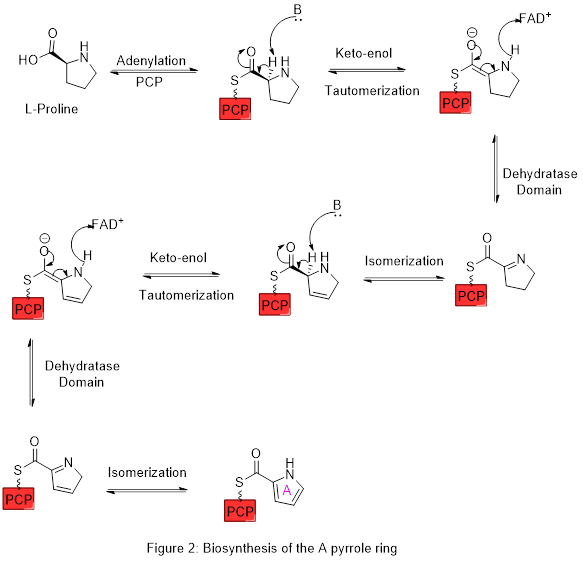
L'anneau A est synthétisé à partir de la L-proline par la voie de la synthase peptidique non ribosomique (NRPS) (figure 2), dans laquelle l'anneau pyrrolidine est oxydé, avec la flavine adénine dinucléotide (FAD+) comme coenzyme pour donner l'anneau pyrrole A. Dans la première étape, la proline est attachée à une protéine peptidyl porteuse (PCP) appelée pigG par l'action de l'enzyme pigI puis l'enzyme pigA effectue l'oxydation.
L'anneau A est ensuite étendu via la voie de la polykétide synthase pour incorporer la L-sérine dans l'anneau B (figure 3). Le fragment de cycle A est transféré de la protéine porteuse de peptidyle (PCP) à la protéine porteuse d'acyle (ACP) par un domaine céto-synthase (KS), suivi d'un transfert vers la malonyl-ACP via une condensation de Claisen décarboxylative catalysée par l'enzyme pigJ. Ce fragment est alors capable de réagir avec le carbanion masqué formé à partir de la décarboxylation médiée par le phosphate de pyridoxal (PLP) de la L-sérine, qui se cyclise dans une réaction de déshydratation pour donner le second cycle pyrrole. Cet intermédiaire est ensuite modifié par oxydation de l'alcool primaire en aldéhyde, catalysée par pigM, et méthylation (qui incorpore un groupe méthyle de la L-méthionine sur l'alcool en position 6) catalysée par pigF et pigN. Cela donne la structure cyclique centrale AB prête pour d'autres transformations, y compris en tambjamines[18] ainsi qu'en prodiginines.
Le cycle C est formé à partir de l'addition décarboxylative médiée par le pyrophosphate de thiamine (TPP) du pyruvate au 2-octénal, catalysée par pigD ; pigE convertit ensuite l'intermédiaire en une amine (à l'aide d'un acide aminé et de PLP) prêt pour la condensation intramoléculaire ; pigB oxyde l'anneau résultant à l'aide d'oxygène et de FAD+, donnant le pyrrole.
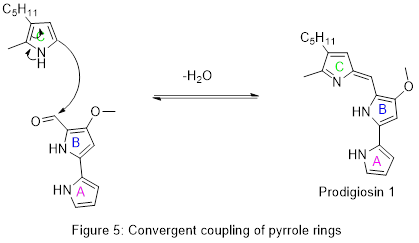
Enfin, les deux pièces sont combinées par pigC et son cofacteur adénosine triphosphate (ATP) dans une réaction de déshydratation qui établit un système conjugué sur les trois anneaux et achève la synthèse de la prodigiosine.
Laboratoire[modifier | modifier le code]
Les détails de la première synthèse totale de prodigiosine ont été publiés en 1962, confirmant la structure chimique. Comme pour la biosynthèse, l'intermédiaire-clé était l'aldéhyde AB illustré à la figure 5[19]. Cet aldéhyde a ensuite été préparé par d'autres méthodes et utilisé pour fabriquer de la prodigiosine et des produits naturels apparentés[16].
Utilisations[modifier | modifier le code]
Les utilisations pharmaceutiques potentielles de la prodigiosine, ou son utilisation comme teinture, ont conduit à étudier sa production à partir de Serratia marcescens, éventuellement après modification génétique[20].
Voir aussi[modifier | modifier le code]
- Obatoclax, un médicament expérimental avec une structure chimique apparentée.
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Prodigiosin » (voir la liste des auteurs).
- « Seeing red: The story of prodigiosin », Adv Appl Microbiol, advances in Applied Microbiology, vol. 47, , p. 1–32 (ISBN 9780120026470, PMID 12876793, DOI 10.1016/S0065-2164(00)47000-0)
- Yu, « Serratia marcescens — Historical Perspective and Clinical Review », New England Journal of Medicine, vol. 300, no 16, , p. 887–893 (PMID 370597, DOI 10.1056/NEJM197904193001604)
- Neil R. Williamson, Peter C. Fineran, Finian J. Leeper et George P. C. Salmond, « The biosynthesis and regulation of bacterial prodiginines », Nature Reviews. Microbiology, vol. 4, no 12, , p. 887–899 (ISSN 1740-1534, PMID 17109029, DOI 10.1038/nrmicro1531, lire en ligne, consulté le )
- M. Todd-Guay and P.H. Demchick. 1995. Role of prodigiosin in phosphate-starved Serratia marcescens. Abstract of the Annual Meeting, American Society for Microbiology.
- « The Mass at Bolsena by Raphael », Vatican Museums (consulté le )
- « Anticancer and immunosuppressive properties of bacterial prodiginines », Future Microbiol., vol. 2, no 6, , p. 605–618 (PMID 18041902, DOI 10.2217/17460913.2.6.605)
- Castro, « Antimalarial Activity of Prodigiosin », Nature, vol. 213, no 5079, , p. 903–904 (PMID 6030049, DOI 10.1038/213903a0, Bibcode 1967Natur.213..903C)
- Berg, G. Diversity of antifungal and plant-associated Serratia plymuthica strains. J. Appl. Microbiol. 88, 952–960 (2000).
- Magae, J., Miller, M. W., Nagai, K. & Shearer, G. M. Effect of metacycloprodigiosin, an inhibitor of killer T cells on murine skin and heart transplants. J. Antibiot. (Tokyo) 49, 86–90 (1996).
- Kataoka et al., « Prodigiosin 25-C uncouples vacuolar type H+-ATPase, inhibits vacuolar acidification and affects glycoprotein processing », FEBS Lett, vol. 359, no 1, , p. 53–59 (PMID 7851530, DOI 10.1016/0014-5793(94)01446-8)
- Rastogi et al., « Synthetic prodigiosenes and the influence of C-ring substitution on DNA cleavage, transmembrane chloride transport and basicity », Org. Biomol. Chem., vol. 11, no 23, , p. 3834–3845 (PMID 23640568, DOI 10.1039/c3ob40477c)
- Perez-Tomas et Vinas, « New Insights on the Antitumoral Properties of Prodiginines », Curr. Med. Chem., vol. 17, no 21, , p. 2222–2231 (PMID 20459382, DOI 10.2174/092986710791331103)
- Feng, Shi, Zhang et Zhang, « Identification of new compounds with high activity against stationary phase Borrelia burgdorferi from the NCI compound collection », Emerging Microbes & Infections, vol. 4, no 5, , e31– (PMID 26954881, PMCID 5176177, DOI 10.1038/emi.2015.31)
- Francis E. Sakai-Kawada, Courtney G. Ip, Kehau A. Hagiwara et Jonathan D. Awaya, « Biosynthesis and Bioactivity of Prodiginine Analogs in Marine Bacteria, Pseudoalteromonas: A Mini Review », Frontiers in Microbiology, vol. 10, , p. 1715 (ISSN 1664-302X, PMID 31396200, PMCID 6667630, DOI 10.3389/fmicb.2019.01715, lire en ligne, consulté le )
- Walsh, Garneau-Tsodikova et Howard-Jones, « Biological formation of pyrroles: Nature's logic and enzymatic machinery », Natural Product Reports, vol. 23, no 4, , p. 517–31 (PMID 16874387, DOI 10.1039/B605245M)
- Dennis X. Hu, David M. Withall, Gregory L. Challis et Regan J. Thomson, « Structure, Chemical Synthesis, and Biosynthesis of Prodiginine Natural Products », Chemical Reviews, vol. 116, no 14, , p. 7818–7853 (ISSN 0009-2665, PMID 27314508, PMCID PMC5555159, DOI 10.1021/acs.chemrev.6b00024, lire en ligne, consulté le )
- R. Caspi, « Pathway: prodigiosin biosynthesis », MetaCyc Metabolic Pathway Database, (consulté le )
- Brass, Klein, Nyholt et Classen, « Condensing Enzymes from Pseudoalteromonadaceae for Prodiginine Synthesis », Advanced Synthesis & Catalysis, (DOI 10.1002/adsc.201900183)
- Rapoport et Willson, « The Preparation and Properties of Some Methoxypyrroles », Journal of the American Chemical Society, vol. 84, no 4, , p. 630–635 (DOI 10.1021/ja00863a025)
- Yip, Yarkoni, Ajioka et Wan, « Recent advancements in high-level synthesis of the promising clinical drug, prodigiosin », Applied Microbiology and Biotechnology, vol. 103, no 4, , p. 1667–1680 (PMID 30637495, DOI 10.1007/s00253-018-09611-z, lire en ligne)