Pinène
Le pinène (C10H16) est un monoterpène bicyclique. On trouve deux isomères structurels du pinène dans la nature : l'α-pinène et le β-pinène, les deux composé étant chiraux et existant chacun sous la forme d'une paire d'énantiomères.
Comme leur nom l'indique, les deux formes sont des constituants importants de la résine de pin ; on les trouve également dans les résines de nombreux autres conifères[1], ainsi que dans des plantes non-conifères telles que le camphrier (Heterotheca)[2], la grande armoise (Artemisia tridentata) ou le chanvre (Cannabis sativa). Les deux isomères sont utilisés par de nombreux insectes dans leur système de communication chimique. Les deux isomères du pinène constituent le principal composant de la térébenthine.
Isomères[modifier | modifier le code]
| Nom | (1R)-(+)-α-pinène | (1S)-(−)-α-pinène | (1R)-(+)-β-pinène | (1S)-(−)-β-pinène |
| Formule topologique | 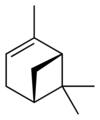 |
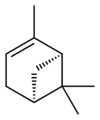 |
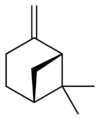 |

|
| Vue en perpsective | X |  |
X | 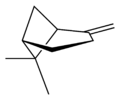
|
| Modèle boules-bâtonnets | X |  |
X | 
|
| Numéro CAS |
Biosynthèse[modifier | modifier le code]
L'α-pinène et le β-pinène sont tous deux produits à partir du pyrophosphate de géranyle, via cyclisation du pyrophosphate de linaloyle suivie de la perte d'un proton depuis le carbocation équivalent. Une équipe de recherche du Georgia Institute of Technology et du Joint BioEnergy Institute a été en mesure de synthétiser du pinène à l'aide d'une bactérie[3].

Plantes[modifier | modifier le code]
L'alpha-pinène est le terpénoïde le plus répandu dans la nature et il est très répulsif pour les insectes. Il apparaît dans les conifères et dans de nombreuses autres plantes.
Le pinène est un composant majeur des huiles essentielles de Sideritis spp. et Salvia spp. (sauge). Le cannabis contient également de l'α-pinène et du β-pinène. La résine de Pistacia terebinthus (communément appelé térébinthe ou arbre à térébenthine) est riche en pinène. Les pignons produits par les pins contiennent du pinène.
Les huiles essentielles d'écorce de combava et de pomélo de Madou ont pour principaux composants sont le limonène et le β-pinène.
Le racémique des deux formes de pinène se retrouve dans certaines huiles comme l'huile d'eucalyptus.
Réactions[modifier | modifier le code]
Le β-pinène peut être converti en α-pinène en présence de bases fortes[4].
Une oxydation sélective du pinène peut se produire en position allylique pouvant donner la verbénone, l'oxyde de pinène, le verbénol, et son hydroperoxyde[5],[6].

L'hydrogénation du pinène donne le pinane, un précurseur de l'hydroperoxyde de pinane.
L'hydroboration de l'α-pinène a été étudiée de façon approfondie. Deux équivalents d'α-pinène réagissent avec le diméthylsulfure de borane (en) pour donner du (diisopinocamphéyl)borane[7]. La réaction avec le 9-BBN donne un réactif appelé « alpine borane (en) », un composé trialkylborane chiral, encombré stériquement capable de réduire stéréosélectivement les aldéhydes dans la réaction connue sous le nom de réduction de Midland par l'alpine borane (en)[8].
Utilisations[modifier | modifier le code]
Les pinènes, en particulier l'isomère α, sont les principaux constituant de la térébenthine, un solvant et un carburant d'origine naturelle[1].
L'utilisation du pinène comme biocarburant dans les moteurs à allumage commandé a été étudiée[9]. Il a été montré que les dimères de pinène avaient un pouvoir calorifique comparable à celui du carburéacteur JP-10[3].
Références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pinene » (voir la liste des auteurs).
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a27_267), « Turpentines »
- Lincoln DE, Lawrence BM, « The Volatile Constituents of Camphorweed, Heterotheca subaxillaris », Phytochemistry, vol. 23, no 4, , p. 933–934 (DOI 10.1016/S0031-9422(00)85073-6)
- Sarria S, Wong B, Martín HG, Keasling JD, Peralta-Yahya P, « Microbial Synthesis of Pinene », ACS Synthetic Biology, vol. 3, no 7, , p. 466–475 (PMID 24679043, DOI 10.1021/sb4001382
 )
)
- Charles A. Brown, Prabhakav K. Jadhav, « (a)-b-PINENE BY ISOMERIZATION OF (B)-b-PINENE », Organic Syntheses, vol. 65, , p. 224 (DOI 10.15227/orgsyn.065.0224)
- (de) Neuenschwander U, Guignard F, Hermans I, « Mechanism of the Aerobic Oxidation of α-Pinene », ChemSusChem, vol. 3, no 1, , p. 75–84 (PMID 20017184, DOI 10.1002/cssc.200900228
 )
)
- Mark R. Sivik, Kenetha J. Stanton, Leo A. Paquette, « (1R,5R)-(+)-Verbenone of High Optical Purity », Organic Syntheses, vol. 72, , p. 57 (DOI 10.15227/orgsyn.072.0057)
- Jason Abbott, Christophe Allais et William R. Roush, « Preparation of Crystalline (Diisopinocampheyl)borane », Organic Syntheses, vol. 92, , p. 26–37 (DOI 10.15227/orgsyn.092.0026
 )
)
- M. Mark Midland "B-3-Pinanyl-9-borabicyclo[3.3.1]nonane" in Encyclopedia of Reagents for Organic Synthesis 2001 John Wiley, New York.DOI 10.1002/047084289X.rp173
- Raman V, Sivasankaralingam V, Dibble R, Sarathy SM, « α-Pinene - A High Energy Density Biofuel for SI Engine Applications », SAE Technical Paper, vol. 1, (DOI 10.4271/2016-01-2171)
