Persulfate de sodium
| Persulfate de sodium | |
 Structure du persulfate de sodium |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.028.993 |
| No CE | 231-892-1 |
| No RTECS | SE0525000 |
| PubChem | 62655 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche cristallisée inodore |
| Propriétés chimiques | |
| Formule | Na2S2O8 |
| Masse molaire[1] | 238,105 ± 0,012 g/mol Na 19,31 %, O 53,76 %, S 26,93 %, |
| Propriétés physiques | |
| Solubilité | 545 g·L-1[2] à 20 °C |
| Masse volumique | 1,2 g·cm-3[2] à 20 °C |
| Précautions | |
| SGH[2] | |
| H272, H302, H315, H317, H319, H334, H335, P220, P261, P280, P305+P351+P338 et P342+P311 |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le persulfate de sodium est un composé chimique de formule Na2S2O8. Il s'agit du sel sodique du persulfate. Il se présente sous la forme d'une poudre blanche cristallisée inodore soluble dans l'eau et pratiquement non hygroscopique.
Préparation[modifier | modifier le code]
On l'obtient par oxydation électrolytique d'hydrogénosulfate de sodium NaHSO4 :
L'oxydation a lieu sur une anode de platine.
Applications[modifier | modifier le code]
Le persulfate de sodium est utilisé essentiellement comme amorceur radicalaire pour les polymérisations en émulsion de polymères à base de styrène comme l'acrylonitrile butadiène styrène (ABS)[3].
Il est également utilisé comme agent de blanchiment et dans des détergents. Il peut remplacer le persulfate d'ammonium pour la gravure du zinc et des circuits imprimés, et est utilisé pour le décapage du cuivre et d'autres métaux. On l'utilise par ailleurs dans l'amendement et la remédiation des sols, ainsi que pour blanchir les tissus en vue de leur teinture.
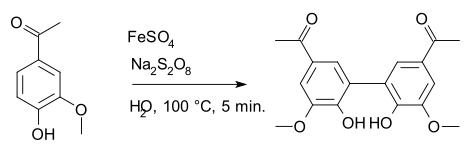
En chimie organique, c'est un oxydant spécialisé dans l'oxydation de Boyland-Sims (en) et l'oxydation au persulfate d'Elbs (en). Il est également utilisé dans les réactions radicalaires, comme la synthèse de la diapocynine à partir de l'apocynine avec le sulfate de fer(II) FeSO4 comme amorceur radicalaire[4].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Sodium peroxidisulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 août 2016 (JavaScript nécessaire)
- (en) Harald Jakob, Stefan Leininger, Thomas Lehmann, Sylvia Jacobi et Sven Gutewort, « Peroxo Compounds, Inorganic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a19_177.pub2)
- (en) Ron Luchtefeld, Mina S. Dasari, Kristy M. Richards, Mikaela L. Alt, Clark F. P. Crawford, Amanda Schleiden, Jai Ingram, Abdel Aziz Amadou Hamidou, Angela Williams, Patricia A. Chernovitz, Grace Y. Sun, Rensheng Luo et Robert E. Smith, « Synthesis of Diapocynin », Journal of Chemical Education, vol. 85, no 3, , p. 411 (DOI 10.1021/ed085p411, lire en ligne)