Oxyhydrogène
L'oxyhydrogène est un gaz composé d'hydrogène et d'oxygène en proportion molaire 2:1 en général. Le gaz peut être obtenu par électrolyse de l'eau. Il est notamment utilisé en soudure comme source de chaleur[réf. nécessaire]. Dans la pratique, un ratio de 4:1 ou 5:1 d'hydrogène et d'oxygène est nécessaire pour éviter une flamme oxydante.
Propriétés[modifier | modifier le code]
L'oxyhydrogène est brûlé lorsqu'il est amené à sa température d'auto-inflammation. Pour un mélange stœchiométrique à pression atmosphérique normale, l'auto-inflammation se produit à environ 570 °C. L'énergie minimale nécessaire pour enflammer un tel mélange avec une étincelle est d'environ 20 µJ. À température et pression normales, le gaz oxhydrique peut brûler quand il comprend entre environ 4 % et 95 % d'hydrogène en volume.
À l'allumage, le mélange de gaz se transforme en vapeur d'eau en libérant de l'énergie qui entretient la réaction : 241,8 kJ d'énergie (PCI) pour chaque mole de H2 brûlé. La quantité d'énergie thermique dégagée est indépendante du mode de combustion, mais la température de la flamme varie. La température maximale d'environ 2 800 °C est atteinte avec un mélange stœchiométrique pur, elle est environ 700 °C plus chaude que dans une flamme d'hydrogène dans l'air. Lorsque l'un des gaz est mélangé au-delà de ce ratio, ou lorsqu'il est mélangé avec un gaz inerte comme l'azote, la chaleur doit se répandre à travers une plus grande quantité de matière et la température est alors inférieure.
Production[modifier | modifier le code]
Un mélange stœchiométrique pur peut être obtenu par électrolyse de l'eau, qui utilise un courant électrique pour dissocier les molécules d'eau :
- électrolyse : 2 H2O → 2 H2 + O2
- combustion : 2 H2 + O2 → 2 H2O
William Nicholson a été le premier à décomposer l'eau de cette manière en 1800. L'énergie nécessaire pour produire le gaz oxhydrique est toujours supérieure ou égale à l'énergie dégagée par la combustion, selon le premier principe de la thermodynamique. De plus l'énergie utilisable pour une application pratique est en général inférieure à l'énergie dégagée, du fait du second principe de la thermodynamique.
Applications[modifier | modifier le code]
On utilise l'oxyhydrogène pour faire une flamme à environ 2 500 °C grâce à un embout fin et un filtre pour réguler la pression à la sortie et pour éviter le retour de flamme.
Éclairage[modifier | modifier le code]
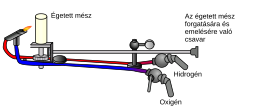
De nombreuses formes de lampes à oxyhydrogène ont été décrites, comme la lumière Drummond, qui utilise une flamme oxhydrique pour chauffer un bloc de chaux qui produit une lumière vive en incandescence. À cause du caractère explosif du gaz oxhydrique, ces éclairages ont été progressivement remplacés par la lampe à incandescence de Thomas Edison.
Soufflet à Oxyhydrogène[modifier | modifier le code]

Le soufflet à oxyhydrogène a été développé par le minéralogiste anglais Edward Daniel Clarke et le chimiste américain Robert Hare au début du XIXe siècle. Il produit une flamme assez chaude pour fondre des matériaux réfractaires comme le platine, la porcelaine ou la brique réfractaire.
Chalumeau à oxyhydrogène[modifier | modifier le code]
Le chalumeau à oxyhydrogène brûle l'hydrogène (le carburant) en présence de l'oxygène (le comburant). Il est utilisé pour la découpe et la soudure des métaux, du verre et thermoplastiques.
En raison de la concurrence du chalumeau acétylène oxygène et du soudage à l'arc, le chalumeau à oxyhydrogène est rarement utilisé aujourd'hui, mais il reste l'outil de coupe préféré dans certains soudages et oxycoupages.

