Monofluorure de chlore
| Monofluorure de chlore | |
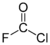
  Structure du monofluorure de chlore |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.300 |
| No CE | 232-229-9 |
| Propriétés chimiques | |
| Formule | ClF |
| Masse molaire[2] | 54,451 ± 0,002 g/mol Cl 65,11 %, F 34,89 %, |
| Moment dipolaire | 0,888 061 D [1] |
| Propriétés physiques | |
| T° fusion | −155,6 °C |
| T° ébullition | −100,1 °C |
| Masse volumique | 1 620 kg·m-3 (liquide à −100 °C) |
| Thermochimie | |
| ΔvapH° | 24 kJ·mol-1 (1 atm, −101,1 °C)[3] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,66 ± 0,01 eV (gaz)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le monofluorure de chlore est un composé chimique de formule ClF. C'est un gaz incolore qui demeure stable même à température élevée. Il se condense à −100 °C en un liquide jaune pâle. Ses propriétés sont souvent intermédiaires entre celles du fluor et du chlore[5].
Le monofluorure de chlore est un agent fluorant polyvalent pouvant agir sur les métaux et les non-métaux pour produire un fluorure en libérant du chlore :
Il peut également former des composés chlorofluorés, par addition sur une double liaison (voire une triple liaison) ou par oxydation :
- CO + ClF →
Notes et références[modifier | modifier le code]
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- (en) Otto Ruff, E. Ascher, « Über ein neues Chlorfluorid-CIF3 », Zeitschrift für anorganische und allgemeine Chemie, vol. 176, no 1, , p. 258–270 (DOI 10.1002/zaac.19281760121)
