Méthacrylate de méthyle
| Méthacrylate de méthyle | |
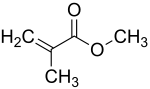
| |
| Structure du méthacrylate de méthyle | |
| Identification | |
|---|---|
| Nom UICPA | 2-méthylprop-2-énoate de méthyle |
| No CAS | |
| No ECHA | 100.001.180 |
| No CE | 201-297-1 |
| No RTECS | OZ5075000 |
| PubChem | 6658 |
| ChEBI | 34840 |
| SMILES | |
| InChI | |
| Apparence | liquide inflammable incolore et très volatil à l'odeur caractéristique dont les vapeurs forment des mélanges explosifs avec l'air[1] |
| Propriétés chimiques | |
| Formule | CH2=C(CH3)COOCH3 |
| Masse molaire[2] | 100,115 8 ± 0,005 2 g/mol C 59,98 %, H 8,05 %, O 31,96 %, |
| Propriétés physiques | |
| T° fusion | −48 °C[1] |
| T° ébullition | 101 °C[1] |
| Solubilité | 15 g/L[1] à 20 °C |
| Masse volumique | 0,94 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 430 °C[1] |
| Point d’éclair | 10 °C[1] (coupelle ouverte), 2 °C (coupelle fermée) |
| Limites d’explosivité dans l’air | entre 1,7 % (70 g/m3) et 12,5 % (520 g/m3)[1] |
| Pression de vapeur saturante | 39,6 hPa[1] à 20 °C |
| Viscosité dynamique | 0,6 mPa s[3] à 20 °C |
| Thermochimie | |
| Cp | |
| Précautions | |
| SGH[1] | |
| H225, H315, H317, H335, P210, P233, P280, P302+P352, P304+P340 et P403+P235 |
|
| SIMDUT[6] | |
  B2, D2B, |
|
| NFPA 704[3] | |
| Transport[1] | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[5] | |
| Écotoxicologie | |
| DL50 | 7 870 mg/kg[1] (souris, oral) |
| LogP | 1,38[1] (octanol/eau) |
| DJA | 0,05 mg/kg p.c./jour[7] |
| Seuil de l’odorat | bas : 0,01 ppm haut : 0,46 ppm[8] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le méthacrylate de méthyle (MMA) est un composé chimique de formule CH2=C(CH3)COOCH3. C'est l'ester d'acide méthacrylique CH2=C(CH3)COOH et de méthanol CH3OH. Il se présente sous la forme d'un liquide inflammable incolore et très volatil à l'odeur caractéristique peu soluble dans l'eau dont les vapeurs forment des mélanges explosifs avec l'air. Il tend à polymériser, surtout s'il contient des impuretés. Cette polymérisation peut être amorcée de manière ciblée, par exemple en ajoutant des peroxydes. La température croît brutalement par effet Trommsdorff et la pression doit être maîtrisée. L'enthalpie de polymérisation est de −59 kJ/mol ou −590 kJ/kg[9].
Le méthacrylate de méthyle est le monomère du polyméthacrylate de méthyle (PMMA), homopolymère dont la production constitue l'essentiel de son utilisation[10] ; il intervient également dans la production de copolymères tels que le méthacrylate de méthyle-butadiène-styrène (MBS), utilisé pour modifier les propriétés du PVC.
Production[modifier | modifier le code]
Compte tenu des volumes de méthacrylate de méthyle produits dans le monde, de nombreuses méthodes ont été développées pour sa production à partir de précurseurs à deux ou quatre atomes de carbone[10],[11]. Deux voies de synthèse sont principalement utilisées.
Par la cyanhydrine d'acétone[modifier | modifier le code]
La cyanhydrine d'acétone (CH3)2C(OH)C≡N, souvent notée ACH, est obtenue par condensation d'acétone (CH3)2C=O et de cyanure d'hydrogène HCN. Elle est hydrolysée en présence d'acide sulfurique H2SO4 pour former un organosulfate de méthacrylamide CH2=C(CH3)CONH2[12]. La méthanolyse de cet ester donne du bisulfate d'ammonium NH4HSO4 et du méthacrylate de méthyle. Cette voie de synthèse produit finalement des quantités importantes de sulfate d'ammonium (NH4)2SO4 comme sous-produit.
- (CH3)C=O + HCN ⟶ (CH3)C(OH)C≡N ;
- (CH3)C(OH)C≡N + H2SO4 ⟶ (CH3)2C(OSO2OH)CONH2.
L'ester est en fait produit initialement sous forme d'adduit (CH3)2C(OSO2OH)CONH2·H2SO4 avec l'acide sulfurique, qui est ensuite clivé par craquage, puis méthanolysée :
Ce mode de synthèse a fait l'objet de nombreuses optimisations[13].
Par le propanoate de méthyle[modifier | modifier le code]
Le propanoate de méthyle CH3CH2COOCH3 est obtenu par carboalcoxylation d'éthylène CH2=CH2[14] :
- C2H4 + CO + CH3OH ⟶ CH3CH2COOCH3.
La synthèse du propanoate de méthyle est réalisée dans un réacteur à réservoir agité en continu à une température et une pression modérées en utilisant un agencement d'agitation et de mélange gaz-liquide spécifiques. Dans un deuxième groupe de réactions, le propanoate de méthyle est condensé avec le formaldéhyde HCHO en une seule étape de réaction hétérogène pour former le méthacrylate de méthyle :
- CH3CH2COOCH3 + HCHO ⟶ CH2=C(CH3)COOCH3 + H2O.
La réaction du propanoate de méthyle avec le formaldéhyde est réalisée sur un lit fixe de catalyseur en oxyde de césium CsO2 sur silice SiO2, qui permet d'obtenir une bonne sélectivité du méthacrylate de méthyle à partir du propanoate de méthyle. Il se forme des résidus de composés plus lourds et peu volatils qui empoisonnent le catalyseur, résidus qui sont facilement nettoyés afin de permettre la régénération du catalyseur et la restauration de la production. Le méthacrylate de méthyle est séparé de l'eau, du propanoate de méthyle du formaldéhyde par une première distillation, tandis que l'eau et le propanoate de méthyle sont recyclés par déshydratation du formaldéhyde. Le méthacrylate de méthyle est purifié à plus de 99,9 % par distillation sous vide.
Autres voies de synthèse[modifier | modifier le code]
Par le propanal[modifier | modifier le code]
L'éthylène C2H4 est d'abord hydroformylé pour donner du propanal CH3CH2CHO, qui est ensuite condensé avec du formaldéhyde HCHO pour produire de la méthacroléine CH2=C(CH3)CHO. La condensation est catalysée par une amine secondaire. L'oxydation à l'air de la méthacroléine en acide méthacrylique CH2=C(CH3)COOH complète la synthèse de l'acide[13] :
- CH3CH2CHO + HCHO ⟶ CH2=C(CH3)CHO + H2O ;
- CH2=C(CH3)CHO + 1⁄2 O2 ⟶ CH2=C(CH3)COOH.
À partir de l'acide isobutyrique[modifier | modifier le code]
L'acide isobutyrique (CH3)2CHCOOH est obtenu par hydrocarboxylation du propylène CH2=CHCH3 en présence de fluorure d'hydrogène comme catalyseur :
- CH2=CHCH3 + CO + H2O ⟶ (CH3)2CHCOOH.
La déshydrogénation oxydante de l'acide isobutyrique donne l'acide méthacrylique CH2=C(CH3)COOH selon une réaction catalysée par des oxydes métalliques[13] :
- (CH3)2CHCOOH + 1⁄2 O2 ⟶ CH2=C(CH3)COOH + H2O.
Par le méthylacétylène[modifier | modifier le code]
Le propyne HC≡CCH3, ou méthylacétylène, est converti en méthacrylate de méthyle par la chimie de Reppe en une étape avec un rendement de 99 % à l'aide d'un catalyseur dérivé d'acétate de palladium(II) (CH3COO)2Pd, ligands phosphine PH3 et acides de Brønsted[13] :
Par l'isobutylène[modifier | modifier le code]
Les réactions par oxydation directe consistent en une oxydation en deux étapes d'isobutylène CH2=C(CH3)2 ou d'alcool tert-butylique (CH3)3COH avec de l'air pour produire de l'acide méthacrylique CH2=C(CH3)COOH et une estérification par le méthanol CH3OH pour produire le méthacrylate de méthyle[13] :
- CH2=C(CH3)2 + O2 ⟶ CH2=C(CH3)CHO + H2O ;
- CH2=C(CH3)CHO + 1⁄2 O2 ⟶ CH2=C(CH3)COOH ;
- CH2=C(CH3)COOH + CH3OH ⟶ CH2=C(CH3)COOCH3 + H2O.
Par le méthacrylonitrile[modifier | modifier le code]
Le méthacrylonitrile CH2=C(CH3)C≡N peut être produit par ammoxydation à partir d'isobutylène CH2=C(CH3)2 :
- CH2=C(CH3)2 + NH3 + 3⁄2 O2 ⟶ CH2=C(CH3)C≡N + 3 H2O.
Cette étape est analogue à la voie industrielle vers l'acrylonitrile CH2=CHC≡N, un composé apparenté. Le méthacrylonitrile peut être hydraté en méthacrylamide CH2=C(CH3)CONH2 par l'acide sulfurique H2SO4 :
- CH2=C(CH3)C≡N + H2SO4 + H2O ⟶ CH2=C(CH3)CONH2·H2SO4 ;
- CH2=C(CH3)CONH2·H2SO4 + CH3OH ⟶ CH2=C(CH3)COOCH3 + NH4HSO4.
Mitsubishi Gas Chemicals a proposé d'hydrater le méthacrylonitrile en méthacrylamide sans utiliser d'acide sulfurique puis de l'estérifier par du formiate de méthyle HCOOCH3 pour obtenir le méthacrylate de méthyle[13] :
- CH2=C(CH3)C≡N + H2O ⟶ CH2=C(CH3)CONH2 ;
- CH2=C(CH3)CONH2 + HCOOCH3 ⟶ CH2=C(CH3)COOCH3 + HCONH2 ;
- HCONH2 ⟶ NH3 + CO.
Estérification de la méthacroléine[modifier | modifier le code]
Asahi Chemical a développé un procédé reposant sur l'estérification oxydante directe de la méthacroléine CH2=C(CH3)CHO, qui ne produit pas de sous-produits tels que le bisulfate d'ammonium NH4HSO4. La matière première est l'alcool tert-butylique, comme dans la méthode par oxydation directe. Dans la première étape, la méthacroléine est produite de la même manière que dans le processus d'oxydation directe par oxydation catalytique en phase gazeuse et est simultanément oxydée et estérifiée dans du méthanol liquide pour obtenir directement le méthacrylate de méthyle[13] :
- CH2=C(CH3)CHO + CH3OH + 1⁄2 O2 ⟶ CH2=C(CH3)COOCH3 + H2O.
Utilisations[modifier | modifier le code]
L'application principale du méthacrylate de méthyle, qui représente environ 75 % du volume produit, est la fabrication de plastiques acryliques en polyméthacrylate de méthyle (PMMA). Le méthacrylate de méthyle est également utilisé pour la production du copolymère méthacrylate de méthyle-butadiène-styrène (MBS), utilisé comme modificateur du PVC. Il est également utilisé dans les prothèses totales de la hanche ainsi que dans les prothèses du genou pour fixer les inserts osseux dans l'os, ce qui réduit significativement les douleurs post-opératoires mais a une durée de vie qui n'excède généralement pas 20 ans, ce qui fait qu'on en réserve l'usage plutôt pour les personnes âgées, les patients plus jeunes étant traités sans PMMA pour allonger la durée de vie des prothèses[15].
Le méthacrylate de méthyle est une matière première pour la fabrication d'autres méthacrylates. C'est par exemple le cas du méthacrylate d'éthyle CH2=C(CH3)COOCH2CH3 (EMA), du méthacrylate de butyle CH2=C(CH3)COOCH2CH2CH2CH3 (BMA) et du méthacrylate de 2-éthylhexyle CH2=C(CH3)COOCH2CH(C2H5)CH2CH2CH2CH3 (2-EHMA). L'acide méthacrylique CH2=C(CH3)COOH (MAA) est utilisé comme intermédiaire ainsi que dans la fabrication de polymères de revêtements, de produits construction et d'applications textiles.
Notes et références[modifier | modifier le code]
- Entrée « Methyl methacrylate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Methyl methacrylate, 99%, stab. », sur Alfa Aesar (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-858-6)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur monographs.iarc.fr, CIRC, (consulté le ).
- « Méthacrylate de méthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- « Methyl methacrylate », sur hazmap.nlm.nih.gov (consulté le ).
- (de) Berufsgenossenschaft Rohstoffe und chemische Industrie, Polyreaktionen und polymerisationsfähige Systeme, brochure R 008, édition de mai 2015, p. 26. (ISBN 978-3-86825-069-5)
- (en) William Bauer Jr., « Methacrylic Acid and Derivatives », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a16_441.pub2, lire en ligne)
- (en) Mohammad Jaber Darabi Mahboub, Jean-Luc Dubois, Fabrizio Cavani, Mohammad Rostamizadeh et Gregory S. Patience, « Catalysis for the synthesis of methacrylic acid and methyl methacrylate », Chemical Society Reviews, vol. 47, no 20, , p. 7703-7738 (PMID 30211916, DOI 10.1039/c8cs00117k, lire en ligne)
- (en) Richard H. Wiley et Walter E. Waddey, « Methacrylamide », Organic Syntheses, vol. 29, , p. 61 (DOI 10.15227/orgsyn.029.0061, lire en ligne)
- (en) Koichi Nagai, « New developments in the production of methyl methacrylate », Applied Catalysis A: General, vol. 221, nos 1-2, , p. 367-377 (DOI 10.1016/S0926-860X(01)00810-9, lire en ligne)
- (en) Scott D. Barnicki, « Chapter 10. Synthetic Organic Chemicals », James A. Kent, Handbook of Industrial Chemistry and Biotechnology, 12e éd., 2012, Springer, New York. (ISBN 978-1-4614-4259-2)
- (en) Margareta Nordin, Basic Biomechanics of the Musculoskeletal System, Lippincott Williams & Wilkins, New York, 2001, p. 401-419. (ISBN 978-0-683-30247-9)
Liens externes[modifier | modifier le code]
- Chemical data on Chemicalland
- US Environmental Protection Agency, 1994 data
- Intox Cheminfo data
- SRI Consulting PEP report
- Methacrylate Producers Association (MPA)
- National Pollutant Inventory - Methyl methacrylate fact sheet
- Basic Acrylic Monomer Manufacturers (BAMM)







