Loi de Dulong et Petit
En thermodynamique, la loi de Dulong et Petit est une loi empirique qui stipule que « la capacité calorifique molaire Cp des éléments solides est voisine de 3R », soit 25 J K‑1 mol−1. Pour la plupart des éléments elle est assez bien vérifiée à température ambiante.
Une loi expérimentale approximative
En 1819 Pierre Louis Dulong et Alexis Thérèse Petit[1] mesurent la capacité thermique massique cp de divers éléments chimiques solides. Les 13 éléments étudiés (S, Fe, Co, Ni, Cu, Zn, Ag, Sn, Te, Pt, Au, Pb, Bi) ont une masse molaire M comprise entre 32 à 209 g/mol. Les résultats montrent que le produit Mcp est indépendant de l'élément considéré et qu'il est égal à 25 J K‑1 mol−1 (à ± 1 J K‑1 mol‑1 près environ). En divisant ce résultat par la constante universelle des gaz parfaits R = 8,314 J K‑1 mol‑1 et en remplaçant Mcp par Cp, capacité calorifique molaire, on en déduit Cp ≈ 3R ce qui constitue la loi de Dulong et Petit.
Pour les valeurs de Cp à 298 K (25 °C) des éléments stables voir le lien capacité calorifique. L'indice p signifie que les valeurs sont mesurées à pression constante.
Pour les éléments solides[Note 1] on observe que :
- Pour la grande majorité des éléments la loi de Dulong et Petit est vérifiée à ± 0,2R près, soit 23 J K−1 mol−1 < Cp < 27 J K−1 mol−1 environ. Des déviations positives un peu plus élevées sont observées pour quelques métaux alcalins et alcalino-terreux, des terres rares et des actinides.
- Pour le gadolinium (Gd) Cp atteint 4,45R.
- Pour 4 éléments (tableau ci-dessous), dont 3 sont des éléments légers, la valeur de Cp est inférieure à 3R.
| Élément | Be | B | C (graphite) | C (diamant) | Si |
|---|---|---|---|---|---|
| Cp/R | 1,97 | 1,34 | 1,02 | 0,74 | 2,41 |
Intérêt historique
Les masses molaires des éléments gazeux ou qui ont des combinaisons gazeuses ont pu être déterminées à l'aide de la loi d'Avogadro[Note 2].
Les métaux et leurs combinaisons sont généralement solides, ce qui ne permet pas d'utiliser cette loi[2]. La composition massique d'un composé solide ne donne sa masse molaire qu'à un facteur près. Ainsi, dans la première version du tableau de Mendeleïev en 1869[3], trois éléments (Ce, In et U) ont été mal placés à cause d'une masse molaire inexacte. Dans le cas de l'oxyde d'uranium le pourcentage en masse de l'oxygène est égal à 11,85 %. À l'époque, la formule supposée de cet oxyde était UO d'où l'on déduit facilement pour l'uranium M = 118 g/mol. Or, la valeur de sa capacité calorifique massique est cp = 0,116 J K‑1 g‑1 ce qui donnerait Cp = M cp = 13,7 J K‑1 mol‑1 = 1,65 R, valeur en désaccord avec la loi de Dulong et Petit. Par contre, si l'oxyde a pour formule UO2 alors M = 238 g/mol et Cp = 3,3 R.
Mendeleïev s'est par la suite appuyé sur les déterminations de cp pour corriger les valeurs de M de ces trois éléments et les repositionner correctement[4].
Un modèle moléculaire commun aux gaz et aux solides
On montre en théorie cinétique des gaz que l'énergie d'agitation thermique U d'une mole de gaz monoatomique est égale 3RT/2. Le facteur 3 correspond aux trois coordonnées - ou degrés de liberté - nécessaires pour déterminer la position de chaque molécule. La capacité calorifique à volume constant CV = dU/dT est donc égale à 3R/2.
Dans un cristal, chaque atome de masse m = M/NA vibre autour de sa position d'équilibre O, sans toutefois la quitter. Son écart par rapport à O est également repérable par 3 coordonnées et son mouvement est celui d'un oscillateur harmonique tridimensionnel. L'énergie moyenne d'un oscillateur harmonique unidimensionnel – ou à un seul degré de liberté - est également partagée entre énergie cinétique et énergie potentielle. En admettant que l'énergie cinétique est encore égale à RT/2 l'énergie totale devient égale à RT. Pour 3 degrés de liberté on en déduit U = 3RT. La capacité calorifique CV à volume constant est donc égale à 3R[Note 3]. On retrouve la loi de Dulong et Petit si l'on néglige l'écart entre Cp et CV.
Le modèle d'Einstein
Le modèle précédent ignore la quantification des valeurs de l'énergie de vibration (niveaux d'énergie) et prévoit que la capacité calorifique est indépendante de T, ce qui n'est pas le cas. Lemodèle d'Einstein tient compte de la quantification de l'énergie.
Les valeurs de l'énergie de vibration d'un atome sont quantifiées (discontinues) et peuvent donc être numérotées : E0, E1, …, Ei, … À la température 0 K tous les atomes possèdent la plus basse énergie possible E0. À la température T les atomes se répartissent sur les différents niveaux.
Le nombre Ni d'atomes d'énergie Ei constitue la population du niveau Ei. Pour des niveaux simples le rapport Nj/Ni des populations de deux niveaux numérotés i et j est donné par la loi de distribution de Boltzmann avec k = R/NA
Dans cette relation le numérateur Ej - Ei représente l'écart entre deux niveaux que l'on mesure le plus souvent par spectroscopie. Le dénominateur kT représente une énergie moyenne d'agitation thermique à l'échelle moléculaire avec kT' = RT/NA.
Dans le cas d'un oscillateur harmonique, les niveaux sont équidistants. Par conséquent, si l'on prend E0 = 0 alors Ev = vE1 avec v = 0, 1, 2, … nombre quantique de vibration. On pose Ev = vhν, où ν est la fréquence de la transition du niveau v = 0 à v = 1. Le modèle de l'oscillateur harmonique représente les vibrations des molécules diatomiques avec une précision satisfaisante.
Le rapport entre l'espacement des niveaux hν et l'énergie d'agitation thermique kT est noté X = hν/kT. La relation de Boltzmann ci-dessus s'écrit Nv = N0e-vX.
Deux cas limites sont à considérer :
- Si X >> 1 alors e-vX est égal à 1 pour v = 0 et nul pour v > 0 : le niveau fondamental est le seul peuplé.
- Si X << 1 alors e-vX décroît lentement en fonction de v et il y a un grand nombre de niveaux peuplés.
Pour aller plus loin, il faut calculer le nombre de particules Nv sur chaque niveau[5]. En écrivant que la somme ΣNv des populations est égale à NA pour 1 mole, on obtient après calcul .
L'énergie d'agitation thermique Uvib est la somme ΣNv Ev des énergies des NA particules d'où l'on déduit après calcul :
La capacité calorifique de vibration s'en déduit par dérivation par rapport à d'où après calcul :
Les fonctions représentant et d'un oscillateur harmonique sont appelées 1re et 2e fonction d'Einstein. On appelle température d'Einstein le rapport si bien que . Pour les atomes d'un solide il y a 3 degrés de liberté donc CV = 3Cvib.
En reprenant les deux cas limite ci-dessus :
- Si X >> 1 alors Uvib et Cvib≈0 : c'est ce qu'il se passe pour la plupart des molécules diatomiques gazeuses.
- Si X << 1 alors Uvib ≈ RT et Cvib ≈R comme on le montre facilement après développement limité de eX.
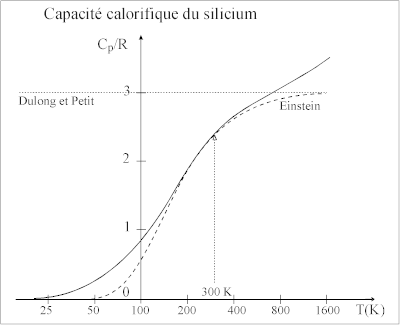
Pour la plupart des éléments solides, et en particulier les métaux courants, la valeur de ne dépasse guère 300 K. Si θE = 300 K alors et on calcule Cvib = 0,92R et CV = 3Cvib = 2,76R. C'est pourquoi, si θE est inférieur à la température ambiante, la loi de Dulong et Petit est approximativement vérifiée, ce qui est le plus souvent le cas.
Si est la constante de force de vibration de l'atome considéré et sa masse de l'atome la température d'Einstein θE = h/f est proportionnelle à ν. Or On trouve donc des valeurs élevées de θE si le rapport f/m est grand. Les 4 éléments (Be, B, C, Si) pour lesquels Cp est très inférieur à 3R sont des éléments légers avec une forte valeur de f et des masses faibles ou modérées. Les valeurs de Cp augmentent avec T pour atteindre 3R et ensuite dépasser largement cette valeur[6].
Les vibrations des atomes ne sont pas localisées mais sont sous forme d'ondes appelées phonons. C'est pourquoi le modèle d'Einstein est grossier et a été remplacé par le modèle de Debye qui donne la même valeur limite 3R de Cp à haute température.
Les autres contributions à la capacité calorifique
Contribution de Cp - CV
Le modèle d'Einstein prévoit que la capacité calorifique CV a pour borne supérieure 3R. Mais en fait c'est Cp que l'on mesure et il dépasse souvent 3R. En thermodynamique, on montre que Cp est toujours supérieur à Cv et que l'écart Cp - CV est donnée par :
Par conséquent Cp est toujours supérieur à CV. Dans cette relation α et κ sont respectivement les coefficients de dilatation cubique et de compressibilité.
Par exemple pour le fer à 298 K : Cp = 25,1 J K−1 mol−1 ou 3,02R, α = 3,54 × 10−5 K−1, V = 7,12 × 10−6 m3, κ = 0,59 × 10−11 Pa−1. On en déduit Cp - CV = 0,44 J K−1 mol−1 ou 0,05R, d'où CV = 2,97R. De fait Cp - CV dépasse rarement 0,1R à quelques exceptions près comme le césium : Cp = 32,2 J K−1 mol−1 ou 3,87R, α = 2,91 × 10−4 K−1, V = 68,6 × 10−4 m3, κ = 0,5 × 10−9 Pa−1, d'où Cp - CV = 3,47 J K−1 mol−1 ou 0,42R et CV = 3,45R.
Capacité calorifique électronique
En thermodynamique statistique, on montre que les électrons des métaux contribuent assez peu à la capacité calorifique et on la néglige donc dans le modèle d'Einstein.

En fait, cette contribution Cél est donnée par :
Cél=γT
La constante γ dépend du métal et elle est le plus souvent de l'ordre de 10-3 à 10 × 10−2 J K−2 mol−1. Pour Fe par exemple γ ≈ 5 × 10−3 J K−1 mol−2 d'où Cél ≈ 1,5 J K−1 mol−1 à 298 K ou encore 0,18R ce qui n'est pas négligeable.
Anharmonicité des vibrations
L'anharmonicité des vibrations de grande amplitude et l'apparition de lacunes contribuent aussi à la capacité calorifique en particulier près de la température de fusion[Note 4].
Transition ferromagnétique
Les métaux ferromagnétiques deviennent paramagnétiques au-dessus d'une certaine température TC dite température de Curie. La capacité calorifique de ces métaux en fonction de la température augmente progressivement lorsqu'on s'approche de TC pour redescendre rapidement ensuite. Ainsi TC = 299 K pour le gadolinium Gd et Cp = 4,45R à 298 K. Dans le cas du fer, le ferromagnétisme disparaît à TC = 1 043 K. Dans cette zone on observe un pic de croissance de Cp qui dépasse 10R. Il s'agit d'une transition du second ordre[7]. Par contre, à 1 185 K le changement de phase [allotropie] est une transition du premier ordre qui se manifeste par une cassure dans la variation de Cp.
Les capacités calorifiques à basse température

À basse température, de l'ordre de quelques kelvins, on se trouve à l'opposé du domaine d'application de la loi de Dulong et Petit. Le modèle de Debye donne la variation correcte de la capacité calorifique Cp qui, compte tenu de la contribution électronique Cél et du fait que Cp ≈ CV, s'écrit Cp = AT3 + γT.
De cette formule, on déduit Cp/T = AT2 + γ. Par conséquent, en portant Cp/T en fonction de T2, on doit obtenir une droite de pente A et d'ordonnée à l'origine γ.
La figure montre que pour le fer γ = 4,9 × 10−3 J K−2 mol−1.
Notes
- Dans la suite on considère des exemples d’éléments solides métalliques (Fe) ou covalents (Si) mais la loi de Dulong et Petit est également observée pour les quelques éléments moléculaires comme I2 ou S8.
- La loi d'Avogadro s'applique à tous les gaz sous basse pression et elle est justifiée par la théorie cinétique des gaz. Au contraire, la "loi" de Dulong et Petit est une règle empirique, comme par exemple la règle de Trouton. L'interprétation détaillée de la capacité calorifique montre qu'elle ne peut être vérifiée qu'à une seule température qui dépend de l'élément considéré.
- C'est pourquoi Cp du fer à 298 K (solide) est le double de CV de l'argon (gaz monoatomique).
- À la température de fusion en général 4R < Cp < 6R, ce qui est évidemment très supérieur aux 3R de la loi de Dulong et Petit.
Références
- A. T. Petit et P. L. Dulong, Recherches sur quelques points importants de la théorie de la chaleur, dans Annales de chimie et de physique, vol. 10, 1819, p. 395–413.
- M. Loing et M. Loing, J. Chem. Educ, 2006, 83, p. 1499-1504.
- D. Mendeleïev, Z. Prakt. Chem. 1869, 106 (4), 251.
- D. Mendeleïev, Le système naturel des éléments, application à la prédiction des propriétés d'éléments encore non découverts, Zhur. Russ. Khim. Obsh., 1871, 3 (2), 25-56.
- A. Pacault, Éléments de thermodynamique statistique, Masson, 1963, p. 77 et 110.
- P.D. Desai, J. Phys. Chem. Ref. Data, 1986, 15, p. 967-983.
- E.A. Guggenheim, Thermodynamique, Dunod, 1965, p. 302-312.
















