Isoaspartate
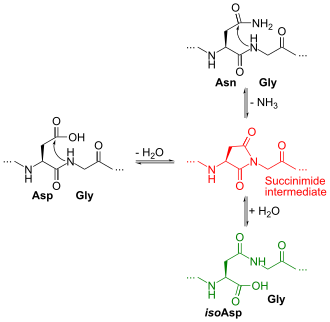
L'isoaspartate (isoAsp) est un résidu d'acide aminé apparaissant dans certaines protéines à la suite d'une réaction intramoléculaire spontanée entre un résidu d'asparagine ou d'aspartate et le résidu d'acide aminé suivant dans la séquence protéique[2] : le résidu Asn ou Asp forme un succinimide intermédiaire[3] qui s'hydrolyse en donnant soit un résidu d'isoaspartate, soit un résidu d'aspartate, dans un rapport d'environ 2:1. Cette réaction explique que l'asparagine soit davantage susceptible de désamination spontanée à pH neutre ou alcalin que la glutamine. De tels réarrangements intramoléculaires surviennent plus facilement au niveau des liaisons peptidiques Asn–Gly, Asn–Ser et Asp–Gly, où la chaîne peptidique est très flexible. Il s'agit de la principale forme de dégradations non enzymatiques des peptides en conditions normales[1].
La protéine L-isoaspartyl méthyltransférase (PIMT) est une enzyme qui convertit les résidus d'isoaspartate en résidus d'aspartate[4],[5].
Notes et références[modifier | modifier le code]
- (en) Dana W Aswad, Mallik V Paranandi et Brandon T Schurter, « Isoaspartate in peptides and proteins: formation, significance, and analysis », Journal of Pharmaceutical and Biomedical Analysis, vol. 21, no 6, , p. 1129-1136 (PMID 10708396, DOI 10.1016/S0731-7085(99)00230-7, lire en ligne)
- (en) Steven Clarke, « Propensity for spontaneous succinimide formation from aspartyl and asparaginyl residues in cellular proteins », International Journal of Peptide and Protein Research, vol. 30, no 6, , p. 808-821 (PMID 3440704, DOI 10.1111/j.1399-3011.1987.tb03390.x, lire en ligne)
- (en) R. C. Stephenson et S. Clarke, « Succinimide formation from aspartyl and asparaginyl peptides as a model for the spontaneous degradation of proteins », Journal of Biological Chemistry, vol. 264, no 11, , p. 6164-6170 (PMID 2703484, www.jbc.org/content/264/11/6164.short)
- (en) Dana W. Aswad et Brett A. Johnson, « The unusual substrate specificity of eukaryotic protein carboxyl methyltransferases », Trends in Biochemical Sciences, vol. 12, , p. 155-158 (DOI 10.1016/0968-0004(87)90073-9, lire en ligne)
- (en) Carsten Ryttersgaard, Scott C. Griffith, Michael R. Sawaya, Duncan C. MacLaren, Steven Clarke et Todd O. Yeates, « Crystal Structure of Human L-Isoaspartyl Methyltransferase », Journal of Biological Chemistry, vol. 277, no 12, , p. 10642-10646 (PMID 11792715, DOI 10.1074/jbc.M200229200, lire en ligne)
