Enthalpie de réaction
L'enthalpie de réaction est une grandeur de réaction associée à l'écriture de l'équation-bilan d'une réaction chimique effectuée à température T et pression p constantes. Elle s'exprime en joule par mole (J/mol), et correspond à la variation d'enthalpie du mélange réactionnel pour 1 mole d'avancement de la réaction en cour. Ainsi, si on connait l'avancement d'une réaction, on peut calculer la variation d'enthalpie provoquée par cette réaction au sein du mélange réactionnel, d'après la relation suivante :
Comme la plupart des réactions chimiques ont lieu à pression constante, l'enthalpie de réaction permet d'avoir accès à la quantité d'énergie libérée sous forme de chaleur car (voir enthalpie).
- Son utilité est donc grande en génie chimique.
Une réaction chimique qui a une enthalpie de réaction négative est dite exothermique, puisqu'elle libère de la chaleur dans l'environnement, alors qu'une réaction chimique dont l'enthalpie de réaction est positive est dite endothermique: elle nécessite un apport de chaleur pour se produire.
Définition thermodynamique
Considérons une réaction chimique dont l'équation bilan est la suivante:
L'enthalpie,H, du système réactionnel est fonction des variables indépendantes T, p, n1, n2,... ni, ...nj ( température, pression et quantité de matière n de chaque constituant du système).
La fonction enthalpie étant une fonction d'état, sa différentielle totale est exacte et peut s'écrire en faisant la somme des différentielles partielles par rapport à chaque variable:
- .
Si la réaction a lieu à température T et à pression p constantes:
- .
- La dérivée partielle de H par rapport à chaque n, toutes les autres variables étant constantes, correspond à l'enthalpie molaire partielle du constituant considéré.
- La dérivée partielle de H par rapport à chaque n, toutes les autres variables étant constantes, correspond à l'enthalpie molaire partielle du constituant considéré.
Chaque variation du nombre de mole dn est reliée à la variation de l'état d'avancement dξ.
- On remplace chaque dn par son expression en fonction de dξ. Puis on regroupe les termes correspondant aux réactifs i et aux produits j.
On obtient:
L'expression:
- correspond à l'enthalpie de réaction de la réaction chimique envisagée à T et p constantes.
L'enthalpie de réaction correspond donc à la différence des enthalpies molaires partielles entre les produits et les réactifs, en tenant compte de la stœchiométrie de la réaction.
On exprime souvent cette relation sans distinguer les réactifs et les produits. Dans ce cas les coefficients stœchiométriques des produits sont positifs, alors que ceux des réactifs sont négatifs.
Calculons alors la variation d'enthalpie du système réactionnel
Intégrons pour un état d'avancement variant de zéro à ξ.
Remarque
- Pour les systèmes réactionnels idéaux (gaz considérés comme parfaits, solutions diluées), l'enthalpie de réaction reste constante au cours d'une réaction. La variation d'enthalpie du système réactionnel ΔH qui est égale à la chaleur Qp, mise en jeu à pression constante, devient égale au produit de l'enthalpie de réaction par l'état d'avancement ξ:
- .
Si la réaction est totale, ξ = 1 mol.
- La valeur de est alors égale à .
- La connaissance de l'enthalpie de réaction permet donc d'avoir accès à la chaleur de réaction.
Enthalpie de réaction et enthalpie de formation
L'enthalpie d'un corps pur ne peut être calculée de façon absolue car elle dépend de l'énergie interne qui n'est pas calculable ( H = U + pV ). Néanmoins, des tables d'enthalpies molaires ont été établies afin de pouvoir calculer rapidement une enthalpie de réaction à partir des valeurs de ces enthalpies molaires : . Cela suppose de définir une échelle arbitraire d'enthalpies molaires en définissant un zéro arbitraire d'enthalpie.
Pour éviter cet inconvénient il a été défini l'enthalpie de formation à T : ou dont les valeurs pour chaque corps pur, pris dans l'état standard, ont été tabulées à la température de référence de 298 K.
L'enthalpie variant très peu en fonction de la pression, on considère qu'elle est pratiquement indépendante de la pression si cette pression n'est pas très élevée et on prendra alors les valeurs définies dans l'état standard.
L'enthalpie de réaction est définie selon:
Ici désigne les coefficients stœchiométriques algébrisés (comptés positivement pour les produits et négativement pour les réactifs).
Elle est alors appelée enthalpie standard de réaction. L'exposant o fait référence à l'état standard, c'est-à-dire que chaque composé i est pur, sous la pression standard de 1 bar. À noter que si pour un liquide, un gaz ou un solide, la notion de «composé pur» est claire, elle est plus problématique pour un composé dissous en solution (p.ex. sel dissous dans de l'eau), on utilise comme état standard le composé infiniment dilué en phase aqueuse.
Problématique de l'état de référence
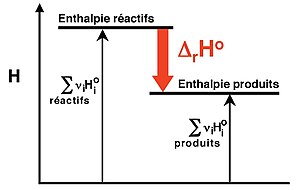
L'enthalpie molaire standard est tabulée pour de nombreux composés. Il est ainsi aisé de calculer par différence l'enthalpie de réaction, à condition de faire attention aux états de référence utilisés (Figure 1). Comme il n'existe pas de zéro absolu pour l'enthalpie, plusieurs états de références ont été définis pour les enthalpies molaires des composés.
Par analogie avec l'altitude, lorsque l'on doit calculer une dénivelée entre deux points, on calcule la différence entre leur altitudes. De manière implicite, on utilise le même état de référence, à savoir que l'altitude au niveau de la mer vaut zéro. On peut tout aussi bien utiliser un autre état de référence (par exemple en admettant que l'altitude au fond de la Fosse des Mariannes vaut zéro), mais un résultat correct n'est obtenu qu'en restant cohérent, à savoir en utilisant le même référentiel pour les points de départ et d'arrivée.
Pour dresser des tables d'enthalpies molaires standards on a choisi de définir l'échelle d'enthalpie de la manière suivante: l'enthalpie molaire standard d'un corps pur simple stable dans l'état standard est nulle à 298 K.
- Exemples:
Néanmoins l'utilisation des enthalpies standards de formation permet d'éviter l'emploi d'une convention arbitraire.
Détermination de l'enthalpie de réaction
Il est possible de déterminer l'enthalpie de réaction par une mesure expérimentale ou par un calcul. Par le calcul, on peut arriver très rapidement à obtenir une valeur approximative à partir des tables thermodynamiques. La mesure expérimentale nécessite un certain savoir-faire et l'utilisation d'un calorimètre ou d'une bombe calorimétrique mais elle permet une détermination plus précise, qui tient notamment compte des conditions réelles de réactions. Elle est de plus bien souvent inévitable pour les composés sur lesquels il n'est pas possible de trouver de l'information dans les bases de données actuelles.
Détermination par le calcul
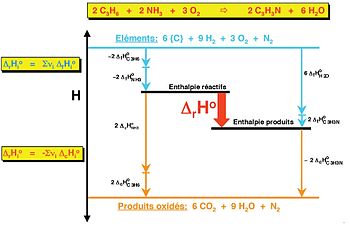
Afin de déterminer une enthalpie de réaction standard par le calcul, on utilise généralement les deux états de référence les plus courants, pour lesquels de nombreuses données sont disponibles. Le premier se base sur les enthalpies de formation. Le second est basé sur les enthalpies de combustion, pour lesquelles le niveau zéro a été fixée pour le CO2 ainsi que pour l'eau, qui sont les produits de combustion d'une molécule organique. Les deux méthodes peuvent être combinées (Figure 2).
Afin de déterminer l'enthalpie de formation ou de combustion d'un composé, il est possible de recourir à la loi de Hess en utilisant les données connues.
Il est également possible d'estimer l'enthalpie de formation d'un composé en connaissant sa structure. Cette méthode, dite de Benson, consiste à additionner les contributions enthalpiques des différents groupes fonctionnels de la molécule.
Détermination expérimentale
En l'absence de données thermodynamiques sur un composé, ou afin d'obtenir une détermination plus précise qui tient compte des conditions réelles de réaction, on procède à la détermination expérimentale de l'enthalpie de réaction. Pour cela les méthodes existantes sont:
Exemples et ordres de grandeur
Valeurs typiques d'enthalpie de réaction:
- Hydrogénation (alcène): -200 kJ/mol
- Amination: -120 kJ/mol
- Neutralisation (acide chlorhydrique): -55 kJ/mol
- Réaction de décomposition (groupe nitro): -350 kJ/mol
Voir aussi
- Thermodynamique
- Enthalpie
- Enthalpie standard de formation
- Grandeur de réaction
- Equilibre chimique
- Pouvoir calorifique
- Relations de Kirchhoff
- Loi de Hess
- Diagramme d'enthalpie
- Calorimétrie
Liens externes
Base de données du "National Institute of Standards and Technology (USA)"
























