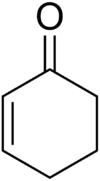
Cyclohexénone
| Cyclohexénone | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | cyclohex-2-én-1-one | ||
| No CAS | |||
| No ECHA | 100.012.021 | ||
| No CE | 213-223-5 | ||
| No RTECS | GW7000000 | ||
| PubChem | 13594 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide marron foncé[1] | ||
| Propriétés chimiques | |||
| Formule | C6H8O [Isomères] |
||
| Masse molaire[2] | 96,127 1 ± 0,005 7 g/mol C 74,97 %, H 8,39 %, O 16,64 %, |
||
| Propriétés physiques | |||
| T° fusion | −53 °C[1] | ||
| T° ébullition | 171 à 173 °C[1] | ||
| Solubilité | 36,2 g·l-1 (eau, 25 °C)[3] | ||
| Masse volumique | 0,993 g·cm-3 (25 °C)[1] | ||
| Point d’éclair | 56 °C (coupelle fermée)[1] | ||
| Pression de vapeur saturante | 3,620 mmHg (25 °C)[3] 1,013 hPa (168 °C)[1] |
||
| Précautions | |||
| SGH[1] | |||
| H226, H310, P261, P280, P310, P301+P310 et P302+P350 |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 170 mg/kg (souris, intrapéritonéal)[4] |
||
| CL50 | 250ppm/4H (rat, inhalation)[5] | ||
| LogP | 0,61[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
La cyclohexénone est un composé organique cyclique de formule C6H8O. C'est un intermédiaire usuel en synthèse organique pour un grand nombre de produits chimiques, composés pharmaceutiques ou parfums[6]. Elle se présente sous la forme d'un liquide brun foncé de point d'ébullition de 171 à 173 °C.
Synthèse[modifier | modifier le code]
La cyclohexénone peut être synthétisée de différentes façons.
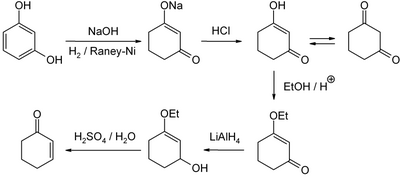
En laboratoire, une méthode à présent bien développée est la réduction et l'hydrolyse acide de la 3-éthoxy-2-cyclohexéne-1-one, qui peut quant à elle être obtenue à partir du résorcinol ou de la cyclohexane-1,3-dione :
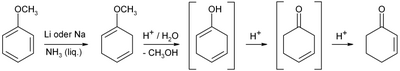
On peut aussi faire réagir l'anisole dans l'ammoniaque par réduction de Birch suivie d'une hydrolyse acide et d'un réarrangement de la double liaison C-C créée :
Il est également possible de faire réagir la cyclohexanone par α-bromation puis élimination, ou encore le 3-chlorocyclohexène par hydrolyse et oxydation.
Dans l'industrie, la cyclohexénone est préparée à partir du phénol par réduction de Birch[7], ou par oxydation catalytique du cyclohexène, par exemple avec du peroxyde d'hydrogène sur un catalyseur au vanadium, de nomreuses méthodes avec différents oxydants et catalyseurs ayant été brevetées.
Réactivité[modifier | modifier le code]
La cyclohexénone est souvent utilisée dans les additions nucléophiles conjuguées avec les organocuprates, dans les additions de Michael et les annélations de Robinson[8],[9].
Notes et références[modifier | modifier le code]
- Fiche Sigma-Aldrich du composé 2-Cyclohexen-1-one, consultée le 27 septembre 2012.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Cyclohexénone », sur ChemIDplus, consulté le 27 septembre 2012
- Personal Communication from H. Zollner, Institut fur Biochemie, Der Universitat, Gras, 23 octobre 1975, vol. 23OCT1975
- American Industrial Hygiene Association Journal. vol. 33, p. 338, 1972, [www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Search&db=PubMed&term=4649066 Pubmed]
- Podraze, K.F. Org. Prep. Proced. Int., 1991, 23, p. 217.
- Organic Building Blocks of the Chemical Industry, Harry H. Szmant, (ISBN 978-0-471-85545-3)
- (en) Michael G. Organ et Paul Anderson, « Carbonyl and Conjugate Additions to Cyclohexenone: Experiments Illustrating Reagent Selectivity », Journal of Chemical Education, vol. 73, no 12, , p. 1 193 (DOI 10.1021/ed073p1193)
- Tet. Lett. 34, 3881, (1993)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Cyclohexenone » (voir la liste des auteurs) et en allemand « 2-Cyclohexen-1-on » (voir la liste des auteurs).