Cubique à faces centrées
Un cristal est dit cubique à faces centrées (cfc) ou simplement cubique faces centrées (en anglais, faces centered cubic ou FCC) lorsque les nœuds de son réseau sont situés :
- aux huit sommets d'un cube ;
- au centre de chacune des faces de ce cube.
Structure[modifier | modifier le code]
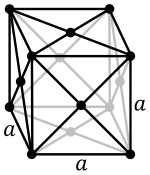
La maille cubique à faces centrées possède 8 × 18 + 6 × 12 = 4 nœuds en propre. Le mode de calcul est simple :
- 8 nœuds aux 8 sommets, chacun partagé entre 8 mailles ;
- 6 nœuds aux centres des 6 faces du cube, chacun partagé entre 2 mailles.
Par exemple, l'or, le cuivre et à certaines températures le fer (fer γ ou austénite) cristallisent dans une structure cfc.
La structure de type diamant peut être décrite comme formée par la compénétration de deux mailles cubiques faces centrées, la deuxième étant décalée d'une translation de a4, b4, c4 et qui présente donc huit atomes par maille. Il s'agit ici d'une simple description qui vise à mettre en évidence la relation avec la structure cubique compacte, car en réalité dans la structure de type diamant il n'y a qu'un seul atome dans l'unité asymétrique. Le carbone sous sa forme diamant et le silicium, un des éléments les plus utilisés en tant que semi-conducteur, cristallisent dans la structure diamant.
Paramètre de maille et rayon atomique[modifier | modifier le code]

En cubique faces centrées, le paramètre de la maille se déduit facilement : (selon la diagonale d'une face du cube) avec rayon de l'atome en question, d'où : .
Le rayon de l'atome peut ainsi être déterminé à partir du paramètre de maille tel que : .
Dans le réseau cubique à faces centrées, la maille élémentaire (primitive) est un rhomboèdre de paramètres : , α = 60°.
Compacité[modifier | modifier le code]
La compacité ou densité, c'est-à-dire la proportion d'espace occupée par les atomes, de la maille cubique faces centrées est de :
C'est la densité maximale possible, aussi atteinte par la maille hexagonale compacte (voir Conjecture de Kepler).
Sites interstitiels[modifier | modifier le code]

La maille élémentaire cubique faces centrées comporte deux types de sites interstitiels où peut se loger, si l'espace est suffisant, un atome (en général) plus petit :
- sites tétraédriques :
situés dans le tétraèdre formé par un atome de coin et les 3 atomes centraux des faces se coupant à ce même coin. Chaque coin est lié à un site tétraédrique, qui sont tous internes à la maille, ce qui fait 8 sites tétraédriques.
- sites octaédriques :
la maille élémentaire cubique faces centrées comporte un site octaédrique au centre de la maille, donc interne à la maille (compte pour 1). Elle comporte aussi un site centré au milieu de chaque arête, partagé par 4 mailles, soit 12 x 1/4 = 3 sites en propre. La maille élémentaire cubique faces centrées comporte donc au total 4 sites octaédriques par maille.
- Remarques
- Des solides comme le chlorure de sodium (sel) ont une structure cristalline de type cfc où tous les sites interstitiels octaédriques sont occupés. Par exemple si l'on considère que les atomes de chlore sont situés aux sommets de la maille, les atomes de sodium occupent alors tous les sites octaédriques de la maille, et vice-versa. La totalité des sites octaédriques (4) est occupée, ce qui correspond aussi au nombre de nœuds par maille, permettant ainsi de respecter la stœchiométrie. Cette structure peut être aussi vue comme deux mailles cfc imbriquées, décalées par un vecteur (1/2 ; 0 ; 0).
- La structure de type « diamant » est une structure de type cubique faces centrées dans laquelle 4 des 8 sites tétraédriques (2 en bas selon une diagonale et 2 en haut selon l'autre diagonale) sont occupés par des atomes de la même espèce que ceux qui composent la maille. La structure de type « blende » est du même type, à la différence que les atomes occupant les sites tétraédriques sont de nature différente (soufre pour une maille de zinc, et vice-versa, pour la sphalérite (ZnS), nom actuel de la blende). La moitié des sites tétraédriques (4) est occupée, ce qui correspond aussi au nombre d'atomes par maille, permettant ainsi de respecter la stœchiométrie. La structure de type diamant peut être aussi vue comme deux mailles cfc imbriquées, décalées par un vecteur (1/4 ; 1/4 ; 1/4).
- Les hydrures métalliques utilisés pour stocker le dihydrogène utilisent les sites tétraédriques ; en général, on utilise un métal de structure cfc dans lequel sont « insérés » des atomes d'hydrogène (ils sont absorbés), qui occupent donc les sites tétraédriques, comme le palladium.







