Cashmeran
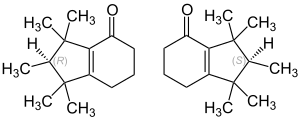
Cashmeran est le nom commercial déposé par International Flavors and Fragrances pour l’ingrédient de parfumerie dont le numéro CAS est et le nom chimique est 6,7-dihydro-1,1,2,3,3-pentaméthyl-4(5H)-indanone. L’abréviation de ce nom chimique est DPMI, qui est également utilisée pour le Cashmeran dans diverses publications.
Propriétés physico-chimiques[modifier | modifier le code]
Le Cashmeran est une cétone alicyclique dont la formule moléculaire est C14H220 et le poids moléculaire est de 206. À température ambiante, c’est un solide blanc dont le point de fusion est de 27 °C. Son point d’ébullition a été déterminé à 256 °C, des tests de décomposition de cette matière ont permis de l’observer à 220 °C[1].
Historique[modifier | modifier le code]
Le Cashmeran a été découvert par International Flavors and Fragrances dans les années 1970, par le Dr John Hall[2]. Son invention est issue de la recherche sur des transformations chimiques peu coûteuses à partir d’ingrédients de structure pentaméthylindane et tétraméthylnaphthalène. Par la suite, le Cashmeran, une cétone insaturée, a été identifié comme un ingrédient important de la parfumerie.
Odeur[modifier | modifier le code]
Même si le Cashmeran a été décrit comme un musc polycyclique, il n’est principalement ni considéré comme un ingrédient à odeur de musc, ni comme un ingrédient faisant partie du groupe des muscs polycycliques tel que défini par l’International Fragrance Association (IFRA).
La définition de l’IFRA pour les muscs polycycliques est la suivante :
- sont utilisés principalement ou uniquement pour leur odeur de musc ;
- ont une des formules moléculaires suivantes : C17H24O ou C18H26O avec un noyau central aromatique benzénique.
Même si le Cashmeran a des notes boisé-musquées, son odeur est complexe[3] de par ses facettes riches, épicées, fruitées, chyprées, balsamiques et vanillées, toutes conférant la sensation sensuelle et douce du cachemire (d’où le nom commercial Cashmeran). En raison de ces particularités, le Cashmeran est utilisé pour son odeur caractéristique, qui diffère assez nettement des ingrédients musqués habituels. Cette constatation est renforcée par le niveau typique de son utilisation d’environ 2 %[4], différent par exemple du musc polycyclique HHCB (Galaxolide) qui est utilisé dans la parfumerie à des concentrations variant de 30-50 %.
De plus, ne possédant pas de noyau aromatique benzénique comme tous les muscs polycycliques, le Cashmeran ne doit pas être classé comme un musc polycyclique.
Données environnementales[modifier | modifier le code]
Le Cashmeran a un facteur de bioconcentration (BCF) de 156 et un coefficient de partage octanol/eau (log Kow) de 4,2[1], ce qui fait que cette matière n’est pas considérée comme très persistante, très bioaccumulable (vPvB), ni comme une substance persistante, bioaccumulable et toxique (PBT).
La toxicité aquatique à court terme du Cashmeran est supérieure à 1 mg/kg pour toutes les espèces (daphnies, algues, poissons). Le Cashmeran est classé dangereux pour l’environnement (R51/53 selon la directive européenne DSD[5] ou H411 selon le règlement européen CLP[6]).
Toutefois, la bioconcentration et la toxicité aquatique du Cashmeran ont un ordre de grandeur plus favorable que les substances considérées comme des muscs polycycliques, et par conséquent il ne répond pas aux critères, ni aux préoccupations environnementales des substances considérées comme appartenant à ce groupe.
Études de contrôle sur l'environnement et sur l'homme[modifier | modifier le code]
Plusieurs études de surveillance ont été conduites dans divers milieux environnementaux et sur l’homme[7],[8],[9],[10],[11],[12],[13],[14],[15]. Dans la plupart des études, le DPMI n’était pas détecté. Plusieurs études ont reporté des traces du DPMI à des niveaux inférieurs à 1 ppm, voire le plus souvent inférieurs à 1 ppb.
En considérant les études sur le devenir de la substance dans l’environnement, la probabilité de trouver du DPMI dans le milieu environnemental est très faible, et même s’il est présent, il l’est à des niveaux extrêmement infimes (de l’ordre du ppm).
Données sur l’homme[modifier | modifier le code]
Le Cashmeran est considéré comme légèrement irritant pour la peau et les yeux (R36/38 selon la directive européenne DSD, H315-319 selon le règlement européen CLP) et comme un faible sensibilisant (R43/H317) avec un EC3 de 33 %. Le Cashmeran n’est pas considéré comme une substance toxique ni CMR[1],[16],[17],[18].
Références[modifier | modifier le code]
- 1,2,3,5,6,7-hexahydro-1,1,2,3,3-pentamethyl-4H-inden-4-one
- US Patent 3,773,836 Nov 20, 1973
- « Unknown page », sur about.com via Wikiwix (consulté le ).
- http://www.iff.com/custom/iff/pdfs/Synthetics_Compendium_A4_Sheets.pdf (Cashmeran)
- (en) « The directive on dangerous substances », sur europa.eu (consulté le ).
- « CLP Legislation - ECHA », sur europa.eu (consulté le ).
- Eschke H.-D., Dibowski H.-J. et Traud J. « Studies on the occurrence of polycyclic musk flavors in different environmental compartments. Second communication: Findings in surface waters, waste waters, and fish as well as in detergents and cosmetics. » Umweltwiss. Schadst.-Forsch. Z. Umweltchem Okotox., 7(3), 131-138
- Eschke H.-D., Dibowski H.-J. et Traud J., Detection and quantitative analysis of musk fragrances by means of ion-trap GC/MS/MS in human fat and breast milk, Deutsche Lebensmittel-Rundschau, 91(12), 375-379.
- Zehringer M. et Herrmann A., Analysis of polychlorinated biphenyls, pyrethroid insecticides and fragrances in human milk using a laminar cup liner in the GC injector, European Food Research and Technology, 212(2), 247-251.
- Hutter H.-P., Wallner P., Moshammer H., Hartl W., Sattelberger R., Lorbeer G. et Kundi M. Blood concentrations of polycyclic musks in healthy young adults. Chemosphere, 59(4), 487-492
- Ricking M., Schwarzbauer J., Hellou J., Svenson A. et Zitko V., Polycyclic aromatic musk compounds in sewage treatment plant effluents of Canada and Sweden--first results, Marine Pollution Bulletin, 46(4), 410-417.
- Zhang S., DiFrancesco, A., Chiu, P., Allen, H. et Salvito, D., Removal mechanisms for fragrance materials in sludge-amended soils, American Chemical Society 228th National Meeting, Philadelphie, PA. 25 août 2004
- Heberer Th., Jurgensen S., Fromme H., Synthetic musks in theaquatic system of Berlin as an example for urban ecosystems, In: Rimkus GH (éd.), Synthetic Musk Fragrances in the Environment, The Handbook of Environmental Chemistry, Springer Verlag, Berlin, Allemagne, p. 123-150
- Schlumpf, M., Kypke, K., Wittassek, M., Angerer, J., Mascher, H., Mascher, D., Vokt, C., Birchler, M. et Lichtensteiger, W., Exposure patterns of UV filters, fragrances, parabens, phthalates, organochlor pesticides, PBDEs, and PCBs in human milk: Correlation of UV filters with use of cosmetics, Chemosphere 81, 1171-1183
- Guo R., Lee I., Kim U., Oh J., Occurrence of synthetic musks in Korean sewage sludges, Science of the Total Environment 408, 1634-1639
- Kevekordes S., Mersch-Sundermann V., Diez M. et Dunkelberg H., In vitro genotoxicity of polycyclic musk fragrances in the micronucleus test, Mutation Research, 395(2-3), 145-150.
- Kevekordes S., Mersch-Sundermann V., Diez M., Bolten C. et Dunkelberg H., Genotoxicity of polycyclic musk fragrances in the sister-chromatid exchange test, Anticancer Research, 18(1A), 449-452.
- Mersch-Sundermann V., Kevekordes S. et Jenter C., Lack of mutagenicity of polycyclic musk fragrances in Salmonella typhimurium, Toxicology in Vitro, 12(4), 389-393.
