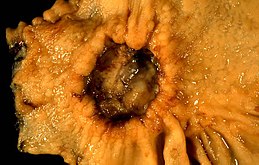
Cancer de l'estomac
| Médicament | Floxuridine (en), méthotrexate, docétaxel, irinotécan, cisplatine, ifosfamide et 5-Fluorouracile |
|---|---|
| Spécialité | Oncologie et gastro-entérologie |
| CISP-2 | D74 |
|---|---|
| CIM-10 | C16 |
| CIM-9 | 151 |
| OMIM | 137215 |
| DiseasesDB | 12445 |
| MedlinePlus | 000223 |
| eMedicine | 278744 |
| MeSH | D013274 |
Le cancer de l'estomac est une forme de cancer se développant aux dépens de la paroi gastrique.
Par définition, l'adénocarcinome gastrique est un cancer de l'épithélium dont le centre est à plus de 2 cm en dessous de la jonction œso-gastrique ; les lésions situées au-dessus de cette limite sont classées dans les tumeurs du cardia. Leur traitement est spécifique.
La plupart des cancers de l'estomac semblent dus à la pullulation et à l'installation dans l'estomac d'une bactérie (Helicobacter pylori) [1] qui produit une protéine oncogène (« Cag »[2],[3] ou CagA[4]) et qui est favorisée par un régime riche en sel[5].
Épidémiologie[modifier | modifier le code]
Les cancers de l'estomac sont la deuxième cause de décès par cancer dans le monde[6],[7].
Ils sont plus fréquents au Japon, en Chine, au Chili et en Irlande[6]. L'incidence annuelle du cancer de l'estomac est en diminution constante depuis vingt ans[6]. En France, elle est actuellement de 7 à 8 000 nouveaux cas par an. En revanche, la fréquence des cancers du cardia est en augmentation.
La survie à 5 ans est de 10 à 15 %[6]. 80 % sont diagnostiqués après l'âge de 65 ans[6]. Les deux tiers le sont à un stade avancé[6].
Facteurs de risque[modifier | modifier le code]
Le cancer de l'estomac est statistiquement lié à un faible niveau socio-économique et à des modes alimentaires spécifiques (fumages, salages). Les facteurs de risque environnementaux sont donc :
- faible consommation de vitamines A, C, et E[1] (produits frais) ;
- alimentation riche en nitrates et/ou sel[8]. Chez l'animal de laboratoire, un excès de sel dans le bol alimentaire favorise le cancer de l’estomac en augmentant la virulence d'Helicobacter pylori[5] ce qui conduit à l'augmentation de la production de la protéine oncogène CagA. Des gerbilles de Mongolie ont été nourries avec un régime salé, les unes ayant été infectées par une souche sauvage normale de H. pylori dite cagA+et les autres par une souche isogène mutante cagA− ne produisant pas cette protéine. 4 mois après l'infection, un adénocarcinome gastrique était détecté chez 100 % des animaux infectés par la souche produisant la protéine cagA et exposée à un régime salé, chez 58 % des animaux exposés à la même souche, mais consommant un régime sans sel, mais chez aucun des animaux infectés par la souche mutante cagA-[5], et les animaux ayant consommé les aliments les plus salés avaient les cancers les inflammations gastriques les plus développées et le pH le plus élevé[5] ;
- le tabagisme[9].
- l'alcoolisme[10].
Certaines affections favorisent le cancer de l'estomac. Ce sont :
- les antécédents de chirurgie gastrique ;
- les inflammations de l'estomac (gastrites) dont celles dues à un reflux ou à l'infection par Helicobacter pylori[11], une bactérie Gram-négative, qui a coévolué avec l'Homme[12], présente chez environ la moitié des êtres humains dans le monde[5], et qui colonise facilement l'estomac et y persiste en résistant à son acidité et à la réponse immunitaire, même forte[13],[14]. La diversité génétique et structurale[15] est chez cette bactérie importante[16], ce qui lui permet de s'adapter à ses hôtes[17]. Seuls certains types d'Helicobacter semblent toutefois plus néfastes[18].
Il existe enfin des prédispositions génétiques aux cancers gastriques (moins de 3 % des cas[19]) :
- syndrome HNPCC ;
- polypose adénomateuse rectocolique familiale ;
- syndrome de Peutz-Jeghers[20] ;
- polypose juvénile ;
- cancers gastriques diffus héréditaires (mutation du gène codant la protéine Cadhérine E constituant un tiers des formes génétiques[19]).
La disparité de la fréquence du cancer selon la géographie est probablement plus due à un facteur environnemental qu'à un facteur génétique, comme peut l'attester l'évolution de la fréquence de la maladie chez les enfants de migrants[21].
Anatomopathologie[modifier | modifier le code]
Il s'agit d'adénocarcinomes dans 85 % des cas[6]. Deux formes sont reconnues :
- les formes intestinales (plutôt bien différenciées), dont on décrit des formes de développement différentes : invasive ou superficielle, végétante ou ulcérée ;
- la linite gastrique, diagnostic macroscopique (paroi rigide blanchâtre épaissie ayant l'aspect du lin).
Les cellules indépendantes « en bague à chaton » sont en faveur d'une linite gastrique mais de façon non exclusive.
Les autres formes histologiques rarement retrouvées sont, dans moins de 15 % des cas, les lymphomes (de type MALT par exemple), et, dans 1 à 3 % des cas, des sarcomes (avec en particulier les GIST) et des métastases d'autres tumeurs.
Il existe deux systèmes de classification des tumeurs gastriques : la classification japonaise[22] et celle, beaucoup plus employée en Europe en Amérique, dite classification TNM[23], décrite ci-dessous :
T0 pas de tumeur
Tis tumeur in situ
T1 extension à la muqueuse ou sous-muqueuse
T2a extension à la musculeuse
T2b extension à la sous-séreuse
T3 extension à la séreuse
T4 extension aux organes adjacents (rate, côlon transverse, foie, diaphragme, pancréas, paroi abdominale, surrénale, rein, intestin grêle ou rétropéritoine)
N0 pas de ganglion
N1 ganglions proximaux
N2 ganglions régionaux
N3 ganglions à distance (foie, rate)
M0 pas de métastase
M1 métastase (y compris ganglion de Troisier)
Symptômes[modifier | modifier le code]
La douleur épigastrique[24], un amaigrissement du ventre et les signes d'anémie sont les symptômes les plus souvent retrouvés. Le ventre peut aussi enfler de manière significative mais la spécificité reste faible pour évoquer ce type d'affection. Le retard diagnostic est estimé à un an après les premiers signes cliniques.
Diagnostic[modifier | modifier le code]
Le diagnostic du cancer de l'estomac est souvent tardif compte tenu du caractère profond de la tumeur et l'absence de symptômes des lésions de petite taille. Les examens indispensables au diagnostic sont la fibroscopie gastrique et le scanner thoraco-abdomino-pelvien.
Les différents marqueurs tumoraux n'ont que peu d'intérêt dans le dépistage ou la surveillance de ce cancer[25].
Fibroscopie gastrique[modifier | modifier le code]
L'endoscopie digestive haute, ou fibroscopie gastrique, permet de faire des prélèvements biopsiques pour analyse anatomo-pathologique et de confirmer rapidement le diagnostic. Les biopsies doivent être multiples. Elle peut être couplée à une échographie (écho-endoscopie) qui permet de correctement stratifier les stades T (classification TNM)[26]. La fibroscopie gastrique s'effectue en ambulatoire et dure de 10 à 20 minutes.
Tomodensitométrie[modifier | modifier le code]
Le scanner thoraco-abdomino-pelvien ou scanner TAP permet de réaliser en un examen le bilan d'extension et parfois d'opérabilité de la tumeur. Elle permet de suspecter, en particulier, une atteinte ganglionnaire et/ou une métastase.
Examens optionnels[modifier | modifier le code]
Une cœlioscopie exploratrice peut être proposée si la tumeur est volumineuse, à l’extirpabilité douteuse au scanner, avec suspicion de métastases hépatiques ou de carcinose péritonéale.
En cas de doute sur une lésion métastatique au scanner, une IRM hépatique peut être nécessaire pour écarter cette hypothèse.
Traitement[modifier | modifier le code]
La prise en charge des cancers de l'estomac a fait l'objet de la publication de recommandations. Celles de l'« European Society for Medical Oncology » datent de 2016[27].
Méthodes thérapeutiques[modifier | modifier le code]
Ablation par fibroscopie[modifier | modifier le code]
Elle peut être proposée pour les tumeurs de petite taille, sans envahissement de la muqueuse sous-jacente[28]. Le risque d'extension aux ganglions est considéré dans ces cas comme très faible. Le pronostic ultérieur est alors excellent[29]. Cette technique peut parfois être étendue s'il existe une faible extension vers la muqueuse gastrique[30].
Chirurgie[modifier | modifier le code]
La chirurgie est le seul traitement éventuellement curatif du cancer de l'estomac. Celle-ci est réalisable chez moins de 50 % des patients. Le geste chirurgical dépend de la localisation de la tumeur et de son extension. La chirurgie est contre-indiquée si l'exérèse ne peut pas être complète ou si l'état de santé du patient ne permet pas de réaliser cette intervention avec un risque post-opératoire satisfaisant. La mortalité liée à la chirurgie curative est estimée à 7 %[6].
L’examen extemporané (c'est-à-dire fait immédiatement, pendant l'acte chirurgical) des marges de résection est recommandé et permet de décider de la suite de l'intervention.
En cas de cancer de l'antre, une gastrectomie distale avec anastomose gastro-jéjunale est faite. La marge de sécurité doit être supérieure à 4 cm s'il s'agit d'un cancer de type histologique intestinal, et à 8 cm si le cancer est de type histologique diffus (classification de Lauren).
En cas de cancer du corps ou de la grosse tubérosité, une gastrectomie totale avec anastomose œso-jéjunale sur anse en Y de Roux est faite.
En cas de cancer de la grande courbure de type T3-T4 et/ou avec adénopathies de l'artère splénique, une splénectomie (ablation de la rate) est à discuter en fonction du terrain.
S'il existe un envahissement des structures de voisinage, il est nécessaire alors de faire une exérèse monobloc sans dissection ni rupture de la pièce (les biopsies sont prohibées).
La chirurgie de la tumeur doit être accompagnée d'un curage ganglionnaire. Ce curage doit permettre d'analyser au moins 20 ganglions dans le voisinage de l'estomac. L'extension exacte de ce curage est encore sujet de discussion, mais il semblerait que l'exérèse ganglionnaire étendue n'apporte pas de gain en termes de survie[6].
Les complications immédiates estimées sont de l'ordre de 10 % : infections intra-abdominales, pancréatites, fistules[6].
Les effets indésirables de la gastrectomie sont les désunions anastomotiques, les ulcères des orifices anastomotiques, les éventrations, lithiases biliaires, diarrhées, dumping syndrome, carences en fer, vitamine B12 ou acide folique[6].
La chirurgie peut être faite de manière traditionnelle, « à ciel ouvert » ou par cœlioscopie[31] (introduction et maniement des instruments par l'intermédiaire de petites incisions et visualisation du champ opératoire par une petite caméra introduite de même).
Radiothérapie[modifier | modifier le code]
La radiothérapie seule n'a pas d'efficacité démontrée dans le traitement à visée curative du cancer de l'estomac, sauf en cas de maladie localisée (mais non extirpable chirurgicalement)[32]. Par contre elle est parfois utilisée dans le traitement palliatif, soit en cas d'obstruction de l'orifice supérieur ou inférieur de l'estomac par la croissance tumorale, soit en cas de saignement gastrique, soit encore dans un but antalgique[6].
La radiothérapie, faite avant l'intervention chirurgicale, pourrait avoir un intérêt, qui semble cependant limité[33].
Radio-chimiothérapie[modifier | modifier le code]
Il semble qu'une radiothérapie associée à une chimiothérapie (radio-chimiothérapie) à base de 5-FU diminue le risque de rechute chez les patients opérés d'un cancer de l'estomac localement évolué. Le protocole utilisé s'appelle protocole Mac Donald[34]. il associe dix à douze cures de chimiothérapie (soit cinq à six mois de traitement) et une radiothérapie pendant 5 semaines à partir du troisième cycle de chimiothérapie. Il s'agit d'un traitement agressif qui doit être réservé à des patients en mesure de le supporter.
Chimiothérapie[modifier | modifier le code]
En traitement adjuvant (débuté en post-opératoire), les résultats des études de chimiothérapie exclusive sont contradictoires. Une majorité d'essais, datant d'avant 2000, sont cependant décevants[35]. Quelques études plus récentes ont de meilleurs résultats[36] : protocole ECF (épirubicine, cisplatine, 5-FU), appelé également MAGIC[37].
En cas de maladie métastatique, par rapport aux soins palliatifs, la chimiothérapie améliore la survie et la qualité de vie[38]. Les taux de réponse sont de 15 à 51 %, les médianes de survie de 6 à 10 mois en fonction des essais[39]. les molécules qui peuvent être utilisées en situation métastatique sont la doxorubicine, l'épirubicine, le 5-Fluoro-uracile, le méthotrexate, le cisplatine et le docetaxel. Il n'existe pas de polychimiothérapie standard acceptée pour la maladie métastatique. Le protocole DCF (docetaxel, 5FU, cisplatine) semble aujourd'hui donner les meilleurs résultats mais avec des toxicités élevées. Le protocole ECF (épirubicine, cisplatine, 5-FU) est utilisé dans plusieurs pays. On utilise parfois aussi le protocole ELF (etoposide, leucovorin, 5-FU) en raison de sa meilleure tolérance en particulier chez les patients plus âgés et plus fragiles.
Un cinquième de ces cancers ont une surexpression de la protéine HER2[40], constituant une cible thérapeutique. Dans ces formes, l'ajout du trastuzumab permet un gain faible sur la durée de survie[41]. Dans les formes résistantes, l'association trastuzumab-deruxtecan permet un bénéficie supplémentaire[42].
Une chimiothérapie intrapéritonéale est parfois proposée pour tenter de réduire le risque d'évolution vers une carcinose péritonéale de mauvais pronostic[43].
Surveillance[modifier | modifier le code]
[Recommandation de la FFCD][44]
Le bénéfice sociologique d'une surveillance après ablation totale de la tumeur n'étant ni confirmé ni infirmé, la pertinence du suivi dépend du patient et de son aptitude à supporter un nouveau traitement en cas de récidive.
En cas de gastrectomie ou de splénectomie le suivi de ces opérations est à réaliser.
Si l'ablation de la tumeur n'est que partielle, ou que des ganglions sont atteints, la suite du traitement sera décidée selon les symptômes.
Pronostic[modifier | modifier le code]
Il semble être très sensiblement meilleur au Japon par rapport aux autres pays, probablement en rapport avec une politique de dépistage précoce dans un pays à forte incidence[19]. Dans les autres pays, la mortalité atteint 75 %[19].
Prévention[modifier | modifier le code]
L'effet de l'éradication systématique par antibiotiques de l'Helicobacter pylori sur l'incidence du cancer de l'estomac est mise en évidence par une étude[45]. La bactérie inhiberait en particulier le gène p53, ce qui permet aux cellules cancéreuses de proliférer[46],[47]. Une autre explication serait liée l'activation de la toxine Caga en association avec le virus d'Epstein-Barr[48]. Le traitement par antibiotique a une efficacité limitée à 80 % des cas[49] à cause en particulier de la présence de biofilms[50]. Une vision plus récente de la microbiologie constate que la bactérie est hébergée par au moins la moitié de la population[51], ce qui en fait plutôt une bactérie du microbiote qui dans 80 % à 90 %[52] des cas ne donnera pas d'ulcère ou de cancer. La suppression de la bactérie dans la flore intestinale serait une cause de développement du syndrome de l'intestin irritable[53]. La bactérie a aussi une action contre l'obésité et le diabète[54]. Seules certaines modifications génétiques de la bactérie auraient une action carcinogène[55],[56]. Les gènes de virulence[57] de la bactérie pourraient s'exprimer en particulier dans le transfert de gènes que l'on observe dans un biofilm et sous l'effet de facteurs externes (alimentation..)[58]. La recherche de ces derniers gènes pourrait être envisagée dans l'optique de la mise au point d'un vaccin[59]. Cependant la détection par analyse métagénomique de ces variations parait assez compliquée étant donné la grande variabilité constatée[60]. L'action de la bactérie serait plutôt liée à sa capacité[61] à former un biofilm qui en attaquant la muqueuse crée l'ulcère ou le cancer[62],[63],[64],[65]. Ainsi dans un biofilm contenant Helicobacter 8% de gènes seraient exprimés en plus[66], par rapport aux formes planctoniques (mobiles). L'Acétylcystéine serait un inhibiteur de son biofilm[67],[68],[69], augmentant ainsi selon certaines études d'au moins 10 %[70],[71] les chances d'éradication de la bactérie par action des antibiotiques. Les études sur l'efficacité de l'Acétylcystéine donnent cependant des résultats plutôt contradictoires[72], en particulier à cause de la diversité des bactéries helicobacter pylori rencontrées, dont les gènes sont assez variables[73],[74],[75] (variabilité justifiant aussi l'antibiorésistance). Une analyse génomique des bactéries Helicobater du patient permettrait d'optimiser le pronostic et le traitement[76],[77],[78].
Notes et références[modifier | modifier le code]
- (en) Wroblewski L, R Peek, Jr. et K Wilson (2010), Helicobacter pylori and gastric cancer: factors that modulate disease risk. Clin Microbiol Rev23:713-739.
- Tegtmeyer N, S Wessler, and S Backert (2011), Role of the cag-pathogenicity island encoded type IV secretion system in Helicobacter pylori pathogenesis ; Febs J 278: 1190-1202.
- Fischer W (2011), Assembly and molecular mode of action of the Helicobacter pylori Cag type IV secretion apparatus. Febs J 278: 1203-1212.
- (en) Odenbreit S, J Puls, B Sedlmaier, E Gerland, W Fischer, and R Haas (2000), Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science 287: 1497-1500.
- (en) Jennifer A. Gaddy et al. (2013), « High dietary salt intake exacerbates Helicobacter pylori induced gastric carcinogenesis » Infection and Immunity.
- Revue prescrire, no 294, avril 2008.
- (en) Kamangar F, Dores GM, Anderson WF, « Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world », J Clin Oncol, 2006;24:2137-2150.
- (en) Tsugane S, Sasazuki S, « Diet and the risk of gastric cancer: review of epidemiological evidence », Gastric Cancer, 2007;10:75-83.
- (en) Ladeiras-Lopes R, Pereira AK, Nogueira A et al. « Smoking and gastric cancer: systematic review and meta-analysis of cohort studies » Cancer Causes Control, 2008;19:689-701.
- (en) I. Tramacere, E. Negri, C. Pelucchi et V. Bagnardi, « A meta-analysis on alcohol drinking and gastric cancer risk », Annals of Oncology: Official Journal of the European Society for Medical Oncology, vol. 23, no 1, , p. 28–36 (ISSN 1569-8041, PMID 21536659, DOI 10.1093/annonc/mdr135, lire en ligne, consulté le )
- (en) Helicobacter and Cancer Collaborative Group, « Gastric cancer and Helicobacter pylori: a combined analysis of 12 case control studies nested within prospective cohorts » Gut, 2001;49:347-353.
- (en) Atherton J et M Blaser (2009), « Coadaptation of Helicobacter pylori and 492 humans : ancient history, modern implications » J Clin Invest. 119: 2475-2487.
- (en) Cover T, and M Blaser (2009), « Helicobacter pylori in health and disease » Gastroenterology 136: 1863-1873.
- (en) Algood H et T Cover, « Helicobacter pylori persistence : an overview of interactions between H. pylori and host immune defenses » Clin Microbiol Rev. 2006;495(19):597-613.
- (en) Hatakeyama M, « Anthropological and clinical implications for the structural diversity of the Helicobacter pylori CagA oncoprotein » Cancer Sci. 2011;102:36-43.
- (en) Blaser M et D Berg (2001), « Helicobacter pylori genetic diversity and risk of human disease » J Clin Invest. 107: 767-773.
- (en) Suerbaum S et C Josenhans, « Helicobacter pylori evolution and 508 phenotypic diversification in a changing host » Nat Rev Microbiol. 2007;5:441-452.
- (en) Yamaoka Y, Kato M, Asaka M, « Geographic differences in gastric cancer incidence can be explained by differences between Helicobacter pylori strains » Intern Med, 2008;47:1077-1083.
- (en) Hartgrink HH, Jansen EP, van Grieken NC, van de Velde CJ, Gastric cancer, Lancet, 2009;374:477-490.
- (en) Shinmura K, Goto M, Tao H et al. A novel STK11 germline mutation in two siblings with Peutz-Jeghers syndrome complicated by primary gastric cancer, Clin Genet, 2005;67:81-86.
- (en) Hanley AJ, Choi BC, Holowaty EJ, « Cancer mortality among Chinese migrants: a review » Int J Epidemiol, 1995;24:255-265.
- (en) Japanese Gastric Cancer Association, Japanese classification of gastric carcinoma—2nd English Edn. Gastric Cancer, 1998;1:10-24.
- UICC, TNM classification of malignant tumors, New York: John Wiley, 2002.
- (en) A Chak, « Gastroesophageal reflux symptoms in patients with adenocarcinoma of the esophagus or cardia », Cancer, vol. 107, no 9, , p. 2160-6 (PMID 17019737, lire en ligne).
- (en) Lai IR, Lee WJ, Huang MT, Lin HH, Comparison of serum CA72-4, CEA, TPA, CA19-9 and CA125 levels in gastric cancer patients and correlation with recurrence, Hepatogastroenterology, 2002;49:1157-1160.
- (en) Kwee RM, Kwee TC, Imaging in local staging of gastric cancer: a systematic review, J Clin Oncol, 2007;25:2107-2116.
- (en) Smyth EC, Verheij M, Allum W et al. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Ann Oncol, 2016;27(Suppl 5):v38-v49
- (en) Nakajima T, Gastric cancer treatment guidelines in Japan, Gastric Cancer, 2002;5:1-5.
- (en) Kim JJ, Lee JH, Jung HY et al. EMR for early gastric cancer in Korea: a multicenter retrospective study, Gastrointest Endosc, 2007;66:693-700.
- Gotoda T, Yamamoto H, Soetikno RM, Endoscopic submucosal dissection of early gastric cancer, J Gastroenterol, 2006;41:929-942.
- (en) Shehzad K, Mohiuddin K, Nizami S et al. Current status of minimal access surgery for gastric cancer, Surg Oncol, 2007;16:85-98.
- (en) Henning GT, Schild SE, Stafford SL et al. Results of irradiation or chemoirradiation for primary unresectable, locally recurrent, or grossly incomplete resection of gastric adenocarcinoma, Int J Radiat Oncol Biol Phys, 2000;46:109-118.
- (en) Fiorica F, Cartei F, Enea M et al. The impact of radiotherapy on survival in resectable gastric carcinoma: a meta-analysis of literature data, Cancer Treat Rev, 2007;33:729-740.
- (en) Macdonald JS, Smalley SR, Benedetti J et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction, N Engl J Med, 2001;345:725-730.
- Mari E, Floriani I, Tinazzi A et al. Efficacy of adjuvant chemotherapy after curative resection for gastric cancer: a meta-analysis of published randomised trials. A study of the GISCAD (Gruppo Italiano per lo Studio dei Carcinomi dell'Apparato Digerente), Ann Oncol, 2000;11:837-843.
- (en) The GASTRIC (Global Advanced/Adjuvant Stomach Tumor Research International Collaboration) Group, Benefit of adjuvant chemotherapy for resectable gastric cancer, a meta-analysis, JAMA, 2010;303:1729-1737 .
- (en) Cunningham D, Allum WH, Stenning SP et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer, N Engl J Med, 2006;355:11-20.
- (en) Glimelius B, Ekstrom K, Hoffman K et al. Randomized comparison between chemotherapy plus best supportive care with best supportive care in advanced gastric cancer, Ann Oncol, 1997;8:163-168.
- Wagner AD, Grothe W, Haerting J, Kleber G, Grothey A, Fleig WE, Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data, J Clin Oncol, 2006;24:2903-2909.
- (en) Van Cutsem E, Bang Y-J, Feng-Yi F et al. HER2 screening data from ToGA: targeting HER2 in gastric and gastroesophageal junction cancer, Gastric Cancer, 2015;18:476-484
- (en) Bang Y-J, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial, Lancet, 2010;376:687-697
- Shitara K, Bang YJ, Iwasa S et al. Trastuzumab Deruxtecan in previously treated HER2-positive gastric cancer, N Engl J Med, 2020;382:2419-2430
- (en) Yan TD, Black D, Sugarbaker PH et al. A systematic review and meta-analysis of the randomized controlled trials on adjuvant intraperitoneal chemotherapy for resectable gastric cancer, Ann Surg Oncol, 2007;14:2702-2713.
- Fédération francophone de cancérologie digestive, présent sur le site de la Société nationale française de gastro-entérologie, chapitre 2.6 [1].
- (en) Fuccio L, Zagari RM, Minardi ME, Bazzoli F, Systematic review: Helicobacter pylori eradication for the prevention of gastric cancer, Aliment Pharmacol Ther, 2007;25:133-141.
- (en) "Stomach bug alters tumor suppressor".
- (en) "2015: Modulation of p53 during bacterial infection"
- (en) "American society of microbiology:Epigenetic Regulation of Tumor Suppressors by Helicobacter pylori Enhances EBV-Induced Proliferation of Gastric Epithelial Cells"
- (en) "2015:Review article: the global emergence of Helicobacter pylori antibiotic resistance "
- (en) "2015:Biofilm Formation by Helicobacter pylori and Its Involvement for Antibiotic Resistance.".
- "Groupe d'étude français des helicobacter".
- (en) "British Society of Gastroenterology: Helicobacter pylori".
- (en) "Nature, 2018:Helicobacter pylori infection and inflammatory bowel disease: a crosstalk between upper and lower digestive tract"
- "Mars, 2013: Hélicobacter pylori, la bactérie qui combat obésité et diabète".
- (en) "Bmj, journal:Pan-genomic analyses identify key Helicobacter pylori pathogenic loci modified by carcinogenic host microenvironments"
- (en) "2018: ArsRS-Dependent Regulation of homB Contributes to Helicobacter pylori Biofilm Formation"
- "Nbci,2019:Helicobacter pylori virulence genes"
- (en) "2019, Frontiers in microbiology: Potential Role of Biofilm Formation in the Development of Digestive Tract Cancer With Special Reference to Helicobacter pylori Infection"
- (en) "nature, Septembre 2019: Immunoinformatics approaches to explore Helicobacter pylori proteome (Virulence Factors) to design B and T cell multi-epitope subunit vaccine"
- (en) "Nature, Aout 2019: Evolutionary mechanism leading to the multi-cagA genotype in Helicobacter pylori"
- (en) "Diversification of the AlpB Outer Membrane Protein of Helicobacter pylori Affects Biofilm Formation and Cellular Adhesion.".
- "Microbiology - Helicobacter pylori (Ulcer)".
- "Pasteur contre Béchamp : le combat stérile des partisans".
- (en) Panan Pattiyathanee, Ratha-korn Vilaichone et Nuntaree Chaichanawongsaroj, "Effect of curcumin on Helicobacter pylori biofilm formation", African Journal of Biotechnology, 2009.
- "Probiotic Lactobacillus fermentum UCO-979C biofilm formation on AGS and Caco-2 cells and Helicobacter pylori inhibition".
- (en) "American society microbiology: Helicobacter pylori Biofilm Involves a Multigene Stress-Biased Response, Including a Structural Role for Flagella"
- "2010, Nbci:Biofilm demolition and antibiotic treatment to eradicate resistant Helicobacter pylori: a clinical trial.".
- (en) "Nbci,2015;Biofilm Formation by Helicobacter pylori and Its Involvement for Antibiotic Resistance".
- (en) "Septembre 2010:Biofilm Demolition and Antibiotic Treatment to Eradicate Resistant Helicobacter pylori: A Clinical Trial".
- (en) "2015,NCbi: An Additive Effect of Oral N-Acetyl Cysteine on Eradication of Helicobacter pylori".
- (en) "2014: Efficacy of Acetylcysteine-containing Triple Therapy in the First Line of Helicobacter pylori Infection".
- (en) "Cochrane Database, 2016: Systematic Reviews N-acetylcysteine as an adjuvant therapy for Helicobacter pylori eradication".
- (en) "Sciences daily, Juillet 2016: Genes found in H. pylori that influence iofilm formation".
- (en) "NCbi, 2016:Comparative Genomics Revealed Multiple Helicobacter pylori Genes Associated with Biofilm Formation In Vitro.".
- "2006:Une mutation dans Helicobacter pylori associée à une résistance au traitement d'éradication".
- (en) "2012:Comparative Genomics of Helicobacter pylori Strains of China Associated with Different Clinical Outcome".
- (en) "2017:Importance of antimicrobial susceptibility testing for the management of eradication in Helicobacter pylori infection".
- (en) "2016,Nbci:Tailored Therapy Versus Empiric Chosen Treatment for Helicobacter pylori Eradication".
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Historiographie : Dissertation sur le cancer de l'estomac présentée et soutenue à la Faculté de Médecine de Paris, le 3 avril 1817, pour obtenir le grade de Docteur en médecine par Jean-Jacques Caboullet.
- Fédération française de cancérologie digestive : Cancer de l'estomac
Bibliographie[modifier | modifier le code]
- (en) Fox J, and T Wang (2007), Inflammation, atrophy, and gastric cancer. J Clin499Invest117:60-69
- (en) IARC (1994), Schistosomes, liver flukes andHelicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 juin 1994. IARC Monogr Eval Carcinog Risks Hum61:1-241
- (en) Odenbreit S, J Puls, B Sedlmaier, E Gerland, W Fischer et R Haas (2000), Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science287:1497-1500
- (en) Hatakeyama M (2011), Anthropological and clinical implications for the structural diversity of the Helicobacter pylori CagA oncoprotein. Cancer Sci102:36-43 (résumé)
- (en) Duncan SS, Valk PL, McClain MS, Shaffer CL, Metcalf JA, Bordenstein SR, Comparative genomic analysis of East Asian and non-Asian Helicobacter pylori strains identifies rapidly evolving genes ; Cover TL. PLoS One. 2013; 8(1):e55120. Epub 2013 Jan 31.
- (en) Evans DJ Jr, Evans DG. (2001), Helicobacter pylori CagA: analysis of sequence diversity in relation to phosphorylation motifs and implications for the role of CagA as a virulence factor ; Helicobacter. 2001 Sep; 6(3):187-98 (résumé).
- (en) Higashi H, Yokoyama K, Fujii Y, Ren S, Yuasa H, Saadat I, Murata-Kamiya N, Azuma T, Hatakeyama M. (2005), EPIYA motif is a membrane-targeting signal of Helicobacter pylori virulence factor CagA in mammalian cells ; J Biol Chem. 2005 Jun 17; 280(24):23130-7. Epub 2005 Apr 13.