Toxaphène
| Toxaphène | |||
| |||
| Identification | |||
|---|---|---|---|
| Synonymes |
Camphène chloré (60 %) |
||
| No CAS | |||
| No ECHA | 100.029.348 | ||
| No CE | 232-283-3 | ||
| PubChem | 5284469 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide cireux, jaune a ambre, d'odeur caracteristique[1]. | ||
| Propriétés chimiques | |||
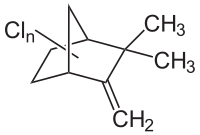
| Formule | C10H8Cl8 [Isomères] |
||
| Masse molaire[2] | 411,795 ± 0,025 g/mol C 29,17 %, H 1,96 %, Cl 68,87 %, |
||
| Propriétés physiques | |||
| T° fusion | 77 °C [3] | ||
| Solubilité | 0,55 mg·l-1 (eau, 20 °C) [3] | ||
| Masse volumique | 1,65 g·cm-3[1] | ||
| Pression de vapeur saturante | à 25 °C : 53 Pa[1] | ||
| Précautions | |||
| SGH[6] | |||
| H301, H312, H315, H335, H351 et H410 |
|||
| SIMDUT[7] | |||
 D1B, D2A, |
|||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 2B : Peut-être cancérogène pour l'homme[5] | |||
| Écotoxicologie | |||
| DL50 | 112 mg·kg-1 (souris, oral) 42 mg·kg-1 (souris, i.p.) [3] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le Toxaphène est un pesticide. Il est composé d'un mélange complexe de terpènes bicycliques polychlorés dont la formule chimique est (C10H10Cl8), le nombre d'atomes de chlore peut varier de 6 à 10. Bien qu'il soit communément appelé Toxaphène, on peut le trouver sous différents noms tels que Camphechlor, Octachlorocamphène ou encore Polychlorocamphène[8],[9],[10]. C'est un solide cireux reconnaissable par sa couleur ambrée.[4]
Ce pesticide est notamment connu pour ses caractéristiques particulières qui en font un contaminant majeur à l'échelle planétaire. En effet, sa persistance dans l'environnement (longue durée de vie), son potentiel de bioaccumulation, sa forte toxicité ainsi que sa capacité à parcourir de longues distances via le transport atmosphérique lui confère une place parmi les douze polluants organiques persistants (POP) qui ont été reconnus par le Programme des Nations unies pour l'environnement. Ce dernier vise dans un premier temps à réduire puis par la suite éliminer leurs rejets à l'échelle mondiale[11].
Historique[modifier | modifier le code]
Le Toxaphène a été produit pour la première fois en 1945 par la compagnie Hercule Powder aux États-Unis. Il fut commercialisé sous le nom de Hercule 3956[12]. Il connaît une forte croissance au début des années 1970 puisqu'il succède au DDT qui vient d'être interdit. Il est alors le pesticide le plus employé à travers le monde entre 1972 et 1984[13]. À cause de sa forte toxicité, il est interdit en 1982 par l'EPA (Environmental Protection Agency) dans plusieurs pays du monde, notamment les États-Unis, le Canada ou encore les pays d'Europe de l'Ouest. Quelques années plus tard, en 1990, la Russie, l'Amérique Centrale ainsi que l'Europe de l'Est cessent de l'utiliser. Sa consommation mondiale est estimée à 1 330 000 tonnes entre 1950 et 1993 dont 40 % utilisé par les États-Unis[12],[14]. Le , plus d'une centaine de pays ont signé le traité environnemental historique à Stockholm conduisant à l'interdiction d'utiliser douze polluants organiques persistants comptant parmi les substances les plus toxiques au monde. Parmi ces douze substances figurent le Toxaphène. Le traité est entré en vigueur en [15]. Malgré son interdiction, le mal est fait et de même que d'autres pesticides, le toxaphène persiste et continue de faire des ravages dans l'environnement.
Usages[modifier | modifier le code]
C'est un insecticide que l'on retrouve surtout dans l'agriculture pour les cultures de céréales, fruits et légumes, et plus particulièrement pour la culture du coton, qui représente 80 % de son application, aux États-Unis.
Il est également utilisé, dans une moindre mesure, pour l'élimination des acariens du bétail ou pour lutter contre la mouche tsé-tsé en zone tropicale.
Enfin, il peut être utilisé en tant que piscicide[12],[16].
Production[modifier | modifier le code]
Il est produit industriellement par le passage d'un gaz chloré au travers une molécule de camphène (dans ce cas, celle-ci est une dérivée de molécules extraites de souches de pins), en présence d'une irradiation UV.
Dispersion dans l'environnement[modifier | modifier le code]
Malgré le fait qu'il ne soit utilisé que pour certaines cultures, parce que très volatil, il se disperse largement dans l'environnement car assez persistant, il peut être transporté sur de longues distances dans l'atmosphère et/ou par les fleuves ou les courants marins. Il en résulte donc une forte dispersion dans le monde. C'est pourquoi, au Canada, où son utilisation a été très réglementé, on le retrouve malgré tout en forte concentrations dans l'environnement et notamment dans la région des Grands Lacs avec une influence importante sur l'écosystème. On le retrouve jusque dans le sang et les graisses de nombreux animaux de l'arctique[17]). Il provient surtout dans ces cas directement des usages qui en sont faits aux États-Unis, même après son interdiction, car les sols contaminés continuent à en libérer. Les usines qui le produisent en libèrent aussi dans l'environnement, les données sur les émissions de toxaphène lors de sa production aux États-Unis indiquent que les réseaux hydrographiques les plus contaminés sont à proximité des usines chimiques qui ont longtemps produit le toxaphène jusqu'à son interdiction[16]. Bien qu'interdit, on le retrouve encore dans l'environnement, car très résistant à la dégradation (selon la composition du sol, il faut de 100 jours à 12 ans pour diminuer de moitié sa concentration[18].)
Toxicité[modifier | modifier le code]
La contamination de l'environnement aquatique (l'eau de surface et le dépôt) peut constituer une menace pour les hommes. La contamination sur l'humain peut être causée soit par contact direct ou soit par contact indirect avec le toxaphène. En général, l'absorption du toxaphène sur la population se fait de trois manières différentes, via l'ingestion (voie orale), via le contact avec la peau et via les poumons (l'inhalation). Pour l'humain, la principale exposition au toxaphène se fait par ingestion, notamment par la consommation de poissons. Des études ont montré que des résidus du toxaphène se retrouvaient dans certains fruits et légumes. L'exposition par inhalation n'est pas très importante[16].
Une importante exposition au toxaphène peut avoir des conséquences considérables sur la santé de l'homme. Des études ont montré la présence d'effets sur le système nerveux ainsi que le système immunitaire. In vitro, on observe, en présence de certains congénères du toxaphène et du toxaphène technique, une diminution œstrogénique mais une augmentation des aberrations chromosomiques chez les femmes fortement exposées ainsi qu'un pouvoir mutagénique. Des études réalisées in vivo montrent que des effets endocriniens sont observés. Le toxaphène est aussi connu et répertorié (EPA, EU, IARC) pour présenter un réel risque sur les hommes quant à son effet cancérigène. Quelques décès (dont une leucémie) lui sont, malheureusement, attribué.[5][16],[19]
L'exposition du toxaphène chez les poissons, qui y sont très sensibles, à un impact considérable. Les différentes études réalisées mettent en avant trois effets importants dû à la présence du toxaphène dans les organismes aquatiques. En effet, il peut réduire la vitamine C présente dans le squelette des poissons entraînant ainsi diverses anomalies. Les principales étant une diminution de la formation de collagène, une diminution de la croissance du squelette ainsi que la malformation des vertèbres. Des études ont montré qu'un complément de vitamine C sur les poissons permet de réduire les effets du toxaphène sur la peau, la croissance et le développement des vertèbres.[6][16] De plus, lorsqu'il est absorbé le toxaphène est distribué à travers tous les organes de l'organisme mais il se concentre particulièrement dans les tissus adipeux et les muscles. L'évacuation est lente ce qui entraîne une bioconcentration chez les poissons. Il est également bioaccumulable puisqu'il se retrouve et s'accumule tout au long de la chaîne alimentaire.
Des effets de sa toxicité sont également observables sur les oiseaux ainsi que sur les mammifères. Pour les oiseaux sauvages, notamment les faisans femelles, le principal effet est la diminution de la ponte des œufs pouvant entraîner la mort des jeunes oiseaux. Les études ont montré qu'une concentration de 10 ppm de toxaphène/mg d'alimentation pouvait être considérée comme le niveau le plus bas de concentration présentant des effets (LOEC) à long terme sur les oiseaux.[7][16] Quant aux mammifères, les études mettant en évidence l'exposition orale chronique effectuée sur des chiens, des cobayes et des rats ont abouti à un certain nombre d'effets sur l'organisme. On observe un endommagement des reins, une affectation du système nerveux central ainsi que des systèmes immunitaires, des effets sur le foie, les glandes thyroïdales. La proportion de tumeurs dans les glandes thyroïdales est augmentée chez les animaux de laboratoires[16],[19].
Une étude effectuée sur les abeilles n'a pas révélé d'effets toxiques sur leur organisme. Il apparaît même que les abeilles sont capables de décomposer et de détoxifier le toxaphène. En effet, le produit est d'abord stocké à 95 % dans l'organisme puis libéré durant les jours suivants sous la forme d'un produit chloré soluble dans l'eau.[8]
Les techniques d'analyses[modifier | modifier le code]
Le toxaphène a été relativement peu étudié par rapport à d'autres pesticides organochlorés tel que le DDT. Plusieurs raisons, notamment des facteurs analytiques, permettent d'expliquer le manque d'intérêt pour ce contaminant. Tout d'abord, plus de 200 congénères du toxaphène sont présents dans l'environnement. Ceci augmente les problèmes d'interférences qui peuvent avoir lieu au cours des analyses avec les autres composés organochlorés bien sûr mais également entre les congénères du toxaphène. Une autre raison est qu'il y a seulement quinze ans, un seul standard était disponible et il comportait plus de 30 000 congénères rendant impossible une quantification approprié pour le toxaphène dans les échantillons environnementaux. C'est pourquoi, le toxaphène représente toujours un défi analytique bien qu'il soit connu depuis longtemps[11].
Afin de pouvoir séparer et quantifier ces différents congénères, des techniques de pointe sont nécessaires. Dès les années 1980, d'importants progrès ont été réalisés en ce qui concerne la sélectivité, la précision et la sensibilité pour les techniques de détection. Il a alors été possible de montrer la présence du toxaphène en très faibles concentrations (au niveau du ppb) chez la population humaine, les organismes aquatiques, dans les sols, l'eau ou encore dans les fruits et légumes[16].
Les techniques les plus utilisées sont la spectrométrie de masse (MS) et la chromatographie en phase gazeuse (GC). La majorité des analyses de toxaphène utilise comme méthode de détection la spectrométrie de masse des ions négatifs à capture d'électrons (ECNI-MS) à cause de sa meilleure sensibilité et de la génération d'un spectre de masse permettant d'obtenir les ions [M]- et [M-Cl]-. Le couplage des deux premières techniques (MS et GC) permet de doser le toxaphène et ses congénères dans différentes matrices complexes. Récemment, la GC-ECNI-haute résolution MS a été utilisée pour quantifier les composés du toxaphène dans les organismes invertébrés aquatiques, les échantillons d'air ou encore les échantillons provenant des sédiments. La spectrométrie de masse à trappe ionique ou GC-EI-MS-MS est décrite comme une bonne méthode pour la quantification du toxaphène. Un groupe de recherche l'a récemment utilisé pour quantifier les congénères du toxaphène ainsi que le toxaphène total dans des échantillons biologiques et des échantillons de poissons. La méthode n'est pas sensible aux diverses interférences ce qui est une grande amélioration par rapport aux autres techniques. Une nouvelle technique couplant un spectromètre de masse avec deux chromatographes en phase gazeuse (Gc x GC-MS) est également très prometteuse quant au résultat qu'il sera possible d'obtenir[12].
Des progrès scientifiques ont également été réalisés pour les techniques d'extractions concernant le toxaphène. L'extraction sous fluide pressurisé (PFE) ainsi que l'extraction assistée par micro ondes sont aujourd'hui plus employées que l'extraction Soxhlet[12].
Solutions[modifier | modifier le code]
Le toxaphène est un pesticide interdit dans tous les pays du monde depuis un certain temps. Cependant, il semble qu'il soit encore utilisé pour certaines cultures dans les pays tropicaux. À la suite de son interdiction, plusieurs composés de remplacements (pas seulement des pesticides) ont été et sont toujours utilisés. Aux États-Unis, le toxaphène a été remplacé, entre autres, par le carbaryl et le malathion pour l'agriculture et par l'amitraz chez les bovins et porcs. En Inde, on retrouve le malathion alors qu'au Maroc ce sont des composés de la famille des organo-phosphorés qui remplacent le toxaphène.[9][13]
Références[modifier | modifier le code]
- CAMPHECHLORE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Toxaphène », sur ChemIDplus, consulté le 7 février 2009
- « toxaphène », sur ESIS, consulté le 7 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur monographs.iarc.fr, CIRC, (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Camphène chloré » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- J. R. Barr, A. R. Woolfitt, V.L. Maggio, D. G. Patterson, Archives of Environmental Contamination and Toxicology, 46, 551-556, 2004
- [1]
- [2]
- B. Gouteux, Le Toxaphene, un défi analytique et environnemental, ISMER, Université du Québec à Rimouski, Qc, Canada / IML, Ministère des Pêches et des Océans, Qc, Canada. Disponible sur le web: [3]
- J .R Kucklick, P.A. Helm, Anal. Bioanal. Chem., 386, 819-836, 2006
- CAOBISCO, IOCCC, Les Pesticides, décembre 1995. Disponible sur le web
- J. Brüschweiler, D. Sprinao, J.R. Schlatter, Mitteilungen aus Lebensmitteluntersuchung und Hygiene, 95, 162-189, 2004
- Greenpeace France, Traité de Stockholm. Disponible sur le web
- Ministerie van Verkeer en Waterstaat, Toxaphene: An Analysis of Possible Problems in the Aquatic Environment, 13 janvier 2000
- TF Bidleman, GW Patton, MD Walla, BT Hargrave W.P. Vass, P. Erickson, B. Fowler, V. Scott et D.J. Gregor (1989), Toxaphene and other organochlorines in Arctic Ocean fauna : evidence for atmospheric delivery ; Arctic JSTOR
- DGDTOX
- H. J.de Geus, H. Besselink, A. Brouwer, J. Klungsyr, B. McHugh, E. Nixon, G. G. Rimkus, P. G. Wester and J. de Boer, Environmental Health Perspectives, Vol 17, Supplément 1, février 1999
Bibliographie[modifier | modifier le code]
- J. R. Barr, A. R. Woolfitt, V.L. Maggio, D. G. Patterson, Archives of Environmental Contamination and Toxicology, 46, 551-556, 2004
- B. Gouteux, Le Toxaphene, un défi analytique et environnemental, ISMER, Université du Québec à Rimouski, Qc, Canada / IML, Ministère des Pêches et des Océans, Qc, Canada. Disponible sur le web: [10]
- J .R Kucklick, P.A. Helm, Anal. Bioanal. Chem., 386, 819-836, 2006
- CAOBISCO, IOCCC, Les Pesticides, . Disponible sur le web: [11]
- J. Brüschweiler, D. Sprinao, J.R. Schlatter, Mitteilungen aus Lebensmitteluntersuchung und Hygiene, 95, 162-189, 2004
- Greenpeace France, Traité de Stockholm. Disponible sur le web:
- Ministerie van Verkeer en Waterstaat, Toxaphene: An Analysis of Possible Problems in the Aquatic Environment,
- H. J.de Geus, H. Besselink, A. Brouwer, J. Klungsyr, B. McHugh, E. Nixon, G. G. Rimkus, P. G. Wester and J. de Boer, Environmental Health Perspectives, Vol 17, Supplément 1,



