Atome à N électrons
En mécanique quantique et physique atomique, on appelle atome à N électrons l'équation de Schrödinger considèrant N électrons gravitant autour d'un noyau de charge Z . Si Z = N × e, où e est la charge élémentaire, il s'agit d'un atome. Si Z = N × e - k, il s'agit d'un anion de charge -k. Si Z = N × e + k, il s'agit d'un cation de charge +k. La série s'appelle isoélectronique.
On constate que le spectre de telles séries sont similaires. Ainsi l'ion hydrure H−, l'hélium, le cation Li+ et le cation Be++ sont comparables.
D'autre part, le comportement chimique d'un chlorure Cl−, de l'argon Ar, et du cation potassium K+, nonobstant leur charges globales différentes, ils sont tous quasi-inertes chimiquement. Aussi bien dans un cristal de chlorure de potassium, la liaison dans le cristal se réduit-elle à une attraction électrostatique de « boules quasi-impénétrables » (ceci résultant du principe d'exclusion de Pauli).
Classification rationnelle[modifier | modifier le code]
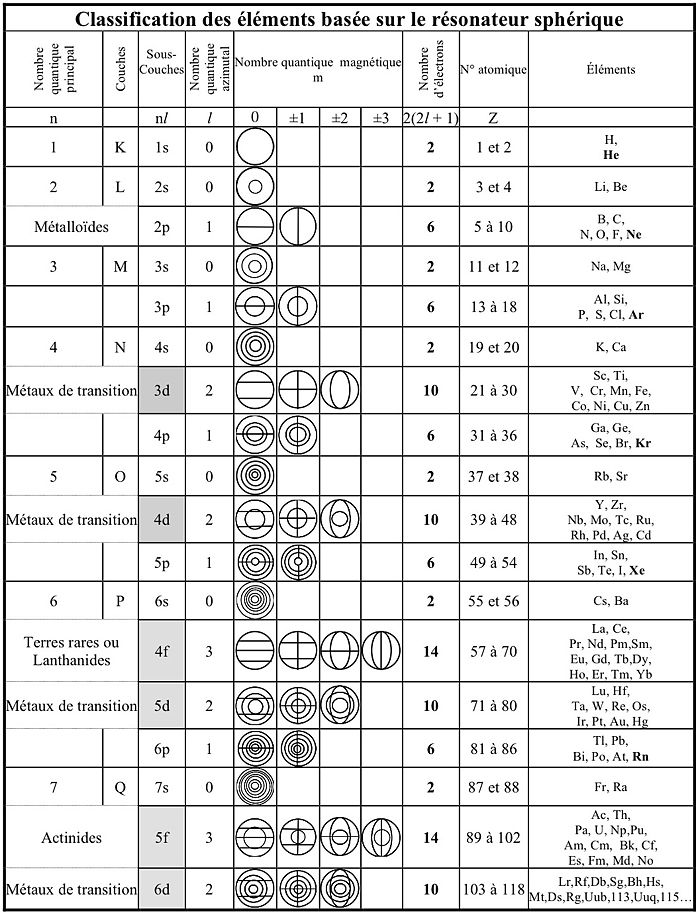
Le tableau ci-après[1] montre la structure vibratoire des éléments chimiques. Cette présentation est celle de Bohr, Sommerfeld, Pauli et d’autres moins connus, appelée classification rationnelle des éléments. Elle est basée sur la théorie de Schrödinger de l'atome d'hydrogène, en ne tenant compte que de façon limitée de la répulsion électrostatique des électrons responsables des permutations de sous-couches.
La sous-couche électronique 3d (3 est le nombre quantique principal n et d correspond au nombre quantique azimutal ou secondaire l=2) ne suit pas immédiatement 3p car 4s s'intercale entre elles. Des sous-couches d, puis f, s'intercalent entre les sous-couches s et p de même nombre quantique principal n. Les sous-couches d et f, en grisé, ont des propriétés physiques et chimiques particulières dues à leur structure électronique.
Chaque élément contient, en plus de sous-couches de sa ligne, toutes les couches qui se trouvent au-dessus. Ces couches internes n'ont généralement d'influence sur la chimie mais peuvent jouer un rôle dans les propriétés physiques (magnétisme, rayons X). Par exemple le numéro atomique du néon Ne, est : Z=2+2+6=10 électrons obtenus en additionnant les électrons des lignes supérieures. La sous-couche 3p du phosphore de configuration électronique contient, dans la sous-couche 3p deux électrons m=0 et un électron m=1. Son numéro atomique est Z=2+2+6+2+3+1=10+2+3, soit celui du néon (Z=10) plus 2 électrons s plus 3 électrons p.
Dans chaque sous-couche, le nombre total de nœuds est égal au n de la sous-couche. En effet le nombre quantique principal n (celui qui détermine le nom, K,L,M,N,P ou Q, de la couche) ne coïncide plus, au-delà de l'argon, avec le n de la sous-couche.
L’hydrogène et l’hélium sont dans la même case car ils ont le même mode de vibration, s, l’un avec un électron et l’autre, deux. Les autres gaz rares ou gaz nobles (ils ne sont plus inertes depuis 1962) ont le mode de vibration p, rempli avec six électrons. Le lutécium et le lawrencium sont dans le bloc d et non dans f. En effet, d’après la théorie de Schrödinger, il y a 7 orbitales soit 14 électrons possibles en vertu du principe d'exclusion de Pauli. On ne peut donc y mettre que 14 éléments et non 15 comme présenté habituellement.
On voit sur la version étendue du tableau périodique des éléments que H et He sont voisins et que Lu et Lw sont bien dans le bloc d.
Atome à 2 électrons[modifier | modifier le code]
A&N = atomes

![{\displaystyle [Ne]3s^{2}3p^{3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9694e80bcf840ef6321589ab15880fa628968428)