Alkylrésorcine
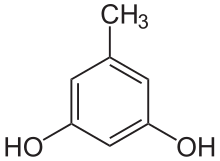

Les alkylrésorcines ou alkylrésorcinols, désignent au sens strict tout omposé constitué dune molécule de résorcine substitué par un groupe alkyle. Dans ce sens, les plus simples alkylréorcines sont les méthylrésorcines dont l'orcinol (5-méthylrésorcine). Dans un sens plus courant, le terme désigne les lipides résorcinoliques, c'est-ä-dire un groupe de lipides phénoliques (en) constitués de longues chaînes aliphatiques liés à des cycles phénoliques de type résorcine[1].
Sources naturelles[modifier | modifier le code]

Les alkylrésorcines sont relativement rares dans la nature. Les sources principales connues sont le blé, le seigle, l'orge, la triticale, le fruit de Ginkgo biloba, et certaines espèces de bactéries. Par exemple, DB-2073 est une molécule aux propriétés antibiotiques isolé à partir du bouillon de culture de Pseudomonas sp.[2]. Les alkylrésorcines sont aussi les principaux constituants de l'enveloppe extérieure du kyste de Azotobacter[3].
Occurrence dans les céréales[modifier | modifier le code]
Les alkylrésorcines sont présentes en grande quantité dans la couche de son (par exemple, dans les couches de péricarpe, de testa et d'aleurone) du blé et du seigle[4] (0,1-0,3 % du poids sec). Des 5-alkylrésorcines sont aussi présentes dans le riz mais pas dans sa partie comestible[5].
Les alkylrésorcines ne sont présentes qu'en très petite quantité dans l'endosperme (partie utilisée pour produire la farine blanche), ce qui en fait des « biomarqueurs » naturels des personnes consommant des produits à base de farine complète[6].
On longtemps cru que les alkylrésorcines avaient des propriétés anti-nutritives (par exemple, diminution de la croissance des porcs et des poulets nourris au seigle), mais cette théorie a été discréditée, et un certain nombre d'études sur les animaux ont démontré qu'elles n'ont aucun effet négatif évident sur les animaux ou les humains[6].
Biomarqueurs d'un régime à base de céréales complètes[modifier | modifier le code]
Des preuves de plus en plus nombreuses provenant d'essais sur l'homme suggèrent qu'ils sont les biomarqueurs les plus prometteurs de la consommation de blé complet et de seigle[7],[8]. L'acide 3,5-dihydroxybenzoïque (DHBA) et l'acide 3,5-dihydroxyphénylpropionoïque (DHPPA), des métabolites d'alkylrésorcines, ont été identifiés pour la première fois dans l'urine[9], ont pu être quantifiés dans l'urine[10] et le plasma[11], et pourraient également servir de biomarqueurs de la consommation de blé complet[12].
La consommation moyenne d'alkylrésorcine est d'environ 11 mg/personne/jour au Royaume-Uni contre environ 20 mg/personne/jour en Suède[13]. Ces quntités varient considérablement selon que les gens consomment normalement du pain complet, qui est riche en alkylrésorcines (300-1000 μg/g), ou du pain blanc, qui en a de très faibles concentrations (<50 μg/g).
Possibles activités biologiques[modifier | modifier le code]
Des éudes in vitro ont montré que les alkylrésorcines pourraient empêcher des cellules de devenir cancereuses, mais n'ont aucun effet sur les cellules déjà cancéreuses[6]. Les alkylrésorcines augmentent aussi les niveaux de γ-tocophérol chez les rats qui en sont nourris en grande quantité (0,2% du régime total et au-delà)[14].
Les alkylrésorcines présentes dans Grevillea banksii et Grevillea 'Robyn Gordon' (en) provoquent des dermatites de contact[15].
Liste des principales alkylrésorcines[modifier | modifier le code]
- Olivétol
- Persoonol
- Grévillol
- Ardisinol I
- Ardisinol II
- Adipostatine A
- Adipostatine B
- Bilobol
- Hexylresorcinol
- Hydrobilobol
- Cardol
- Rucinol
- Irisrésorcinol
- Panosialine
- Stemphol
- R-léprosol
- α-léprosol
- Acide mérulinique
- Xénognosine[16]
Dérivés[modifier | modifier le code]
La sorgoléone est un exsudat racinaire hydrophobe de Sorghum bicolor[17].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Alkylresorcinol » (voir la liste des auteurs).
- S. R. Baerson, J. Schröder, D. Cook, A. M. Rimando, Z. Pan, F. E. Dayan, B. P. Noonan et S. O. Duke, « Alkylresorcinol biosynthesis in plants: New insights from an ancient enzyme family? », Plant Signaling & Behavior, vol. 5, no 10, , p. 1286–1289 (PMID 20861691, PMCID 3115369, DOI 10.4161/psb.5.10.13062)
- N. Kanda, N. Ishizaki, N. Inoue, M. Oshima et A. Handa, « DB-2073, a new alkylresorcinol antibiotic. I. Taxonomy, isolation and characterization », The Journal of Antibiotics, vol. 28, no 12, , p. 935–942 (PMID 1206006, DOI 10.7164/antibiotics.28.935)
- N. Funa, H. Ozawa, A. Hirata et S. Horinouchi, « Phenolic lipid synthesis by type III polyketide synthases is essential for cyst formation in Azotobacter vinelandii », Proceedings of the National Academy of Sciences, vol. 103, no 16, , p. 6356–6361 (PMID 16597676, PMCID 1458882, DOI 10.1073/pnas.0511227103)
- Y. Suzuki, « Structures of 5-alkylresorcinol-related analogues in rye », Phytochemistry, vol. 52, no 2, , p. 281–289 (DOI 10.1016/S0031-9422(99)00196-X)
- Y. Suzuki, M. Kurano, Y. Esumi, I. Yamaguchi et Y. Doi, « Biosynthesis of 5-alkylresorcinol in rice: Incorporation of a putative fatty acid unit in the 5-alkylresorcinol carbon chain », Bioorganic Chemistry, vol. 31, no 6, , p. 437–452 (PMID 14613765, DOI 10.1016/j.bioorg.2003.08.003)
- A. B. Ross, A. Kamal-Eldin et P. Aman, « Dietary alkylresorcinols: Absorption, bioactivities, and possible use as biomarkers of whole-grain wheat- and rye-rich foods », Nutrition Reviews, vol. 62, no 3, , p. 81–95 (PMID 15098855, DOI 10.1301/nr.2004.mar.81-95)
- R. Landberg, A. Kamal-Eldin, A. Andersson, B. Vessby et P. Aman, « Alkylresorcinols as biomarkers of whole-grain wheat and rye intake: Plasma concentration and intake estimated from dietary records », The American Journal of Clinical Nutrition, vol. 87, no 4, , p. 832–838 (PMID 18400704, DOI 10.1093/ajcn/87.4.832)
- R. Landberg, A. Kamal-Eldin, S. -O. Andersson, J. -E. Johansson, J. -X. Zhang, G. Hallmans et P. Aman, « Reproducibility of Plasma Alkylresorcinols during a 6-Week Rye Intervention Study in Men with Prostate Cancer », Journal of Nutrition, vol. 139, no 5, , p. 975–980 (PMID 19321581, DOI 10.3945/jn.108.099952)
- A. B. Ross, P. Åman et A. Kamal-Eldin, « Identification of cereal alkylresorcinol metabolites in human urine—potential biomarkers of wholegrain wheat and rye intake », Journal of Chromatography B, vol. 809, no 1, , p. 125–130 (PMID 15282102, DOI 10.1016/j.jchromb.2004.06.015)
- A. Koskela, A. -M. Linko-Parvinen, P. Hiisivuori, A. Samaletdin, A. Kamal-Eldin, M. J. Tikkanen et H. Adlercreutz, « Quantification of Alkylresorcinol Metabolites in Urine by HPLC with Coulometric Electrode Array Detection », Clinical Chemistry, vol. 53, no 7, , p. 1380–1383 (PMID 17495018, DOI 10.1373/clinchem.2006.084764)
- A. Koskela, A. Samaletdin, M. N. Aubertin-Leheudre et H. Adlercreutz, « Quantification of Alkylresorcinol Metabolites in Plasma by High-Performance Liquid Chromatography with Coulometric Electrode Array Detection », Journal of Agricultural and Food Chemistry, vol. 56, no 17, , p. 7678–7681 (PMID 18690683, DOI 10.1021/jf801252s, CiteSeerx 10.1.1.533.1473)
- M. Aubertin-Leheudre, A. Koskela, A. Marjamaa et H. Adlercreutz, « Plasma Alkylresorcinols and Urinary Alkylresorcinol Metabolites as Biomarkers of Cereal Fiber Intake in Finnish Women », Cancer Epidemiology, Biomarkers & Prevention, vol. 17, no 9, , p. 2244–2248 (PMID 18768490, DOI 10.1158/1055-9965.EPI-08-0215)
- A. B. Ross, W. Becker, Y. Chen, A. Kamal-Eldin et P. Aman, « Intake of alkylresorcinols from wheat and rye in the United Kingdom and Sweden », The British Journal of Nutrition, vol. 94, no 4, , p. 496–499 (PMID 16197572, DOI 10.1079/bjn20051511)
- A. B. Ross, Y. Chen, J. Frank, J. E. Swanson, R. S. Parker, A. Kozubek, T. Lundh, B. Vessby, P. Aman et A. Kamal-Eldin, « Cereal alkylresorcinols elevate gamma-tocopherol levels in rats and inhibit gamma-tocopherol metabolism in vitro », The Journal of Nutrition, vol. 134, no 3, , p. 506–510 (PMID 14988438, DOI 10.1093/jn/134.3.506)
- J. Menz, E. R. Rossi, W. C. Taylor et L. Wall, « Contact dermatitis from Grevillea 'Robyn Gordon' », Contact Dermatitis, vol. 15, no 3, , p. 126–131 (PMID 2946534, DOI 10.1111/j.1600-0536.1986.tb01311.x)
- A. Kozubek et J. H. P. Tyman, « Resorcinolic Lipids, the Natural Non-isoprenoid Phenolic Amphiphiles and Their Biological Activity », Chemical Reviews, vol. 99, no 1, , p. 1–26 (PMID 11848979, DOI 10.1021/cr970464o)
- F. E. Dayan, A. M. Rimando, Z. Pan, S. R. Baerson, A. L. Gimsing et S. O. Duke, « Sorgoleone », Phytochemistry, vol. 71, no 10, , p. 1032–1039 (PMID 20385394, DOI 10.1016/j.phytochem.2010.03.011)
