Éthoxyde de tantale(V)
| Éthanolate de tantale(V) | |
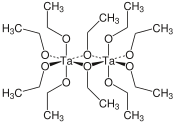 Dimère d'éthanolate de tantale(V) |
|
| Identification | |
|---|---|
| Synonymes |
éthylate de tantale(V) |
| No CAS | |
| No ECHA | 100.025.464 |
| No CE | 228-010-2 |
| PubChem | 160806 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | C10H25O5Ta |
| Masse molaire[1] | 406,250 4 ± 0,011 3 g/mol C 29,56 %, H 6,2 %, O 19,69 %, Ta 44,54 %, |
| Propriétés physiques | |
| T° fusion | 21 °C[2] |
| T° ébullition | 155 °C[2] à 10 Pa |
| Masse volumique | 1,566 g·cm-3[2] à 25 °C |
| Point d’éclair | 29 °C[2] |
| Précautions | |
| SGH[2] | |
| H226, H314, P280, P310 et P305+P351+P338 |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'éthoxyde de tantale(V), anglicisme désignant improprement l'éthanolate de tantale(V), est un composé organométallique de formule chimique Ta(OCH2CH3)5 se présentant sous la forme d'un liquide combustible incolore qui se dissout dans certains solvants organiques mais s'hydrolyse rapidement[4]. En solution, il forme un dimère[5] [(EtO)4Ta(μ2-OEt)]2 à géométrie bioctaédrique[6]. Plusieurs méthodes sont connues pour produire de l'éthanolate de tantale(V), mais la plus efficace est généralement la métathèse du chlorure de tantale(V) TaCl5[7]. L'éthanolate de tantale(V) est utilisé pour donner des couches minces d'oxyde de tantale(V) Ta2O5 par dépôt chimique en phase vapeur (CVD)[8], Atomic Layer Deposition[9] et procédé sol-gel[10] pour des applications comme matériaux semiconducteurs[9], électrochromes[11] et pour traitements optiques[8].
Structure[modifier | modifier le code]
Les alcoolates métalliques adoptent rarement une configuration monomérique et l'éthanolate de tantale(V) ne fait pas exception. Il a été rapidement établi que les alcoolates de tantale en solution forment des dimères[5] avec des centres métalliques octaédriques hexacoordonnés[12]. Les analyses cristallographiques ont établi par la suite que le méthanolate et l'isopropanolate de niobium adoptent une configuration bioctaédrique[6],[13]. Chaque atome de tantale est coordonné à quatre ligands éthylate monodentates et deux ligands éthylate pontants. Les atomes d'oxygène des éthylates pontants sont liés chacun à deux atomes de tantale et sont en position cis l'un par rapport à l'autre sur la sphère de coordination. La formule [(EtO)4Ta(μ2-OEt)]2 représente plus en détail cette structure dimère, bien que la formule simplifiée Ta2(OEt)10 soit couramment employée.
Production[modifier | modifier le code]
Le chlorure de tantale(V) Ta2Cl10 constitue un point de départ pratique pour la préparation de l'éthanolate de tantale(V). La réaction directe avec l'éthanol HOCH2CH3 est possible et est accompagnée par la production de chlorure d'hydrogène HCl, qui donne de l'acide chlorhydrique HCl(aq) en solution aqueuse :
Malheureusement, les conditions acides favorisent la génération d'espèces mixtes chlorure-éthanolate de tantale TaClx(OEt)5−x, 0 < x < 5, ce qui diminue le rendement et complique la purification de l'éthylate de tantale(V) produit[7]. Pour cette raison, de l'ammoniac NH3 est généralement ajouté pour piéger l'HCl libéré et maintenir des conditions de réaction basiques[7] :
Les conditions basiques augmentent la concentration en ion éthanolate EtO−, ce qui favorise la réaction car ces ions sont des nucléophiles nettement plus efficaces pour substituer les ligands chlorure que l'alcool parent. C'est la raison pour laquelle la métathèse utilisant un alcoolate de métal alcalin est la méthode de production la plus efficace de l'éthanolate de tantale(V)[7] :
Il est également possible de préparer l'éthanolate de tantale(V) par électrochimie[14],[6]. Les deux demi-réactions s'écrivent :
L'éthanolate de tantale(V) a été produit par électrochimie à l'échelle commerciale en Russie[14]. Il a également été préparé par réaction directe de l'éthanol avec le métal, selon une réaction globale identique à celle réalisée par électrochimie[7].
Réactions[modifier | modifier le code]
La réaction la plus importante des alcoolates de tantale est leur hydrolyse pour produire des couches minces et des gels d'oxydes de tantale. Bien que ces réactions soient complexes, la formation d'une couche mince d'oxyde de tantale(V) Ta2O5 par hydrolyse d'éthanolate de tantale(V) peut être décrite par l'équation simplifiée :
Un traitement optique par dépôt d'un revêtement d'éthanolate de tantale(V) peut être réalisé par dépôt chimique en phase vapeur basse pression. À des pressions aussi faibles que 1,33 mPa et des températures de l'ordre de 700 °C, une couche de silice SiO2 de l'épaisseur souhaitée est d'abord déposée par décomposition d'orthosilicate de tétraéthyle Si(OEt)4 ou de di-t-butyoxydiacétoxysilane Si(OC(CH3)3)2(OOCCH3)2, puis l'éthanolate de tantale(V) est introduit dans la réaction. Comme dans le cas de l'éthanolate de niobium, l'éthanolate se décompose thermiquement pour donner une couche d'oxyde avec libération d'éther diéthylique Et–O–Et :
Il est possible de déposer des films d'oxyde de tantale(V) par dépôt chimique en phase vapeur à travers une pyrolyse qui oxyde entièrement l'éthanolate de tantale(V) en dioxyde de carbone CO2 et eau H2O :
Des couches d'oxyde de tantale(V) amorphe peuvent être obtenues par Atomic Layer Deposition ou par dépôt chimique en phase vapeur pulsée, technique dans laquelle l'éthanolate de tantale(V) Ta2(OC2H5)10 et le chlorure de tantale(V) Ta2Cl10 sont alternativement utilisés[9]. Les films déposés à des températures voisines de 450 °C présentent des indices de réfraction et des permittivités semblables à ceux des matériaux obtenus avec des procédés plus conventionnels. Ces dépôts libèrent du chloroéthane ClCH2CH3[9] :
Les procédés sol-gel permettent d'obtenir des couches minces d'oxyde de tantale(V) Ta2O5[10] selon un mécanisme apparenté ; des modes de production de couches superposées de Ta2O5 à structure pérovskite ont également été développés[15].
Applications[modifier | modifier le code]
Les couches minces d'oxyde de tantale(V) Ta2O5 sont utilisées dans une grande variété d'applications, notamment comme films optiques ayant des indices de réfraction atteignant 2,039[16] et comme matériaux diélectriques pour DRAM et transistors à effet de champ à semiconducteurs.
Le procédé utilisé pour réaliser ces couches minces dépend de l'application et des propriétés recherchées. L'hydrolyse directe est appropriée lorsque la présence d'eau résiduelle ou le séchage à haute température sont acceptables. Des micromotifs peuvent être réalisés par hydrolyse de dépôts localisés formant une monocouche auto-assemblée suivie d'un recuit à haute température[17]. Des couches d'oxyde de tantale(V) Ta2O5 amorphes produites par hydrolyse d'éthanolate de tantale(V) sont utilisées dans des applications électrochromes à base de « verres intelligents (en) », tirant parti de la propriété de Ta2O5 à s'assombrir sous l'effet de l'application d'un champ électrique.
Le dépôt chimique en phase vapeur permet de contrôler l'épaisseur des couches déposées à l'échelle du nanomètre, ce qui est indispensable pour certaines applications.
La pyrolyse directe est pratique dans le cadre de certaines applications optiques où la réalisation de matériaux transparents présentant une faible déperdition de lumière par absorption est critique. Elle a également été utilisée pour la réalisation de ROM en nitrure.
Des couches minces métalliques mixtes ont été préparées à partir d'éthanolate de tantale(V). Le tantalate de lithium LiTaO3 est ainsi un matériau recherché pour ses propriétés optiques non linéaires et peut être obtenu en faisant d'abord réagir de l'éthanolate de tantale(V) avec du dipivaloylméthanate de lithium Li–CH(–C(=O)C(CH3)3)2 afin d'obtenir un précurseur pouvant être utilisé par épitaxie en phase vapeur aux organométalliques (MOCVD)[18].
Des couches de tantalate de strontium Sr(TaO3)2 ont également été obtenues par des techniques d'Atomic Layer Deposition et les propriétés des matériaux obtenus ont été étudiées[19].
L'éthanolate de tantale(V) est également utilisé en recherche sur de nouveaux matériaux présentant des propriétés chimiques ou géométriques intéressantes. Avec un procédé apparenté à l'hydrolyse, le traitement aux acides carboxyliques donne des oxo-alcoolate-carboxylates tels que Ta4(μ3-O)4(OEt)8(OOCCH3)4. Le noyau Ta4O4 de ces composés présente une géométrie cubique semblable au noyau carboné du cubane. Chaque ligand oxo est pontant avec trois centres tantale, qui sont également liés à deux ligands alcoolate et un ligand carboxylate.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Tantalum(V) ethoxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 octobre 2013 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Tantalum(V) ethoxide electronic grade, ≥95%, ≥99.999% metals basis, consultée le 18 octobre 2013.
- (en) David R. Lide, « CRC Handbook of Chemistry and Physics », 87e édition (2006), CRC Press, Boca Raton, États-Unis. (ISBN 0-8493-0487-3).
- (en) D. C. Bradley et C. E. Holloway, « Nuclear magnetic resonance studies on niobium and tantalum penta-alkoxides », Journal of the Chemical Society A: Inorganic, Physical, Theoretical, vol. 0, , p. 219-223 (lire en ligne) DOI 10.1039/J19680000219
- (en) N.Ya. Turova, A.V. Korolev, D.E. Tchebukov et A.I. Belokon, « Tantalum(V) alkoxides : Electrochemical synthesis, mass-spectral investigation and oxoalkoxocomplexes », Polyhedron, vol. 15, no 21, , p. 3869-3880 (lire en ligne) DOI 10.1016/0277-5387(96)00092-7
- (en) U. Schubert, « 7.10 – Sol–Gel Processing of Metal Compounds », Reference Module in Chemistry, Molecular Sciences and Chemical Engineering – Comprehensive Coordination Chemistry II, vol. 7, , p. 629-656 (lire en ligne) DOI 10.1016/B0-08-043748-6/06213-7
- (en) P. W. Baumeister, « Optical Coating Technology », SPIE Press (2004), p. 7. (ISBN 9780819453136).
- (en) Kaupo Kukli, Mikko Ritala et Markku Leskelä, « Atomic Layer Deposition and Chemical Vapor Deposition of Tantalum Oxide by Successive and Simultaneous Pulsing of Tantalum Ethoxide and Tantalum Chloride », Chemistry of Materials, vol. 12, no 7, , p. 1914-1920 (lire en ligne) DOI 10.1021/cm001017j
- (en) S. Winter, D. Velten, F. Aubertin, B. Hoffmann, F. Heidenau, G. Ziegler, « Chemical Surface Modifications », dans J. Breme, C. J. Kirkpatrick, R. Thull, « Metallic Biomaterial Interfaces », p. 51, John Wiley & Sons (2008), (ISBN 9783527318605).
- (en) Fatma Z. Tepehan, Ferhad E Ghodsi, Nilgun Ozer et Galip G Tepehan, « Optical properties of sol–gel dip-coated Ta2O5 films for electrochromic applications », Solar Energy Materials and Solar Cells, vol. 59, no 3, , p. 265-275 (lire en ligne) DOI 10.1016/S0927-0248(99)00041-0
- (en) D. C. Bradley et H. Holloway, « Metal oxide alkoxide polymers: part II. The hydrolysis of tantalum pentaethoxide », Revue canadienne de chimie, vol. 39, no 9, , p. 1818-1826 (lire en ligne) DOI 10.1139/v61-239
- (en) Kenneth D. Karlin, Ram C. Mehrotra et Anirudh Singh, « Recent Trends in Metal Alkoxide Chemistry », Progress in Inorganic Chemistry, vol. 46, (lire en ligne) DOI 10.1002/9780470166475.ch4
- (en) D. C. Bradley, R. C. Mehrotra, I. P. Rothwell, A. Singh, « Alkoxo and Aryloxo Derivatives of Metals » (2e édition), p. 18, Academic Press (2001). (ISBN 9780121241407).
- (en) H. S. Nalwa, « Handbook of Advanced Electronic and Photonic Materials and Devices: Chalcogenide Glasses and Sol-Gel Materials », Academic Press (2001), p. 208. (ISBN 9780125137553).
- (en) Mohamed Oubaha, Salem Elmaghrum, Robert Copperwhite, Brian Corcoran, Colette McDonagh et Arnaud Gorin, « Optical properties of high refractive index thin films processed at low-temperature », Optical Materials, vol. 34, no 8, , p. 1366-1370 (lire en ligne) DOI 10.1016/j.optmat.2012.02.023
- (en) Yoshitake Masuda, Shinichi Wakamatsu et Kunihito Koumoto, « Site-selective deposition and micropatterning of tantalum oxide thin films using a monolayer », Journal of the European Ceramic Society, vol. 24, no 2, , p. 301-307 (lire en ligne) DOI 10.1016/S0955-2219(03)00230-9
- (en) Alex A. Wernberg, Gabriel Braunstein, Gustavo Paz‐Pujalt, Henry J. Gysling et Thomas N. Blanton, « Solid‐phase epitaxial growth of lithium tantalate thin films deposited by spray‐metalorganic chemical vapor deposition », Applied Physics Letters, vol. 63, no 3, , p. 331-333 (lire en ligne) DOI 10.1063/1.110061
- (en) Won-Jae Lee, In-Kyu You, Sang-Ouk Ryu, Byoung-Gon Yu, Kyoung-Ik Cho, Soon-Gil Yoon1 et Chun-Su Lee, « SrTa2O6 Thin Films Deposited by Plasma-Enhanced Atomic Layer Deposition », Japanese Journal of Applied Physics, vol. 40, , p. 6941-6944 (lire en ligne) DOI 10.1143/JJAP.40.6941




