Molécule

Une molécule est une structure de base de la matière appartenant à la famille des composés covalents. L'Union internationale de chimie pure et appliquée définit la molécule comme « une entité électriquement neutre comprenant plus d'un atome »[1]. C'est l'assemblage chimique électriquement neutre d'au moins deux atomes, différents ou non, qui peut exister à l'état libre, et qui représente la plus petite quantité de matière possédant les propriétés caractéristiques de la substance considérée. Les molécules constituent des agrégats atomiques liés par des forces de valence (liaisons covalentes) et elles conservent leur individualité physique. Des forces plus faibles, telles les liaisons hydrogène et celles de type van der Waals, les maintiennent à proximité les unes des autres à l'état liquide et/ou solide.
L'assemblage d'atomes constituant une molécule n'est pas définitif, il est susceptible de subir des modifications, c’est-à-dire de se transformer en une ou plusieurs autres molécules ; une telle transformation est appelée réaction chimique. En revanche, les atomes qui la constituent sont des assemblages (de particules) beaucoup plus stables, qui se conservent durant une réaction chimique car la transformation d'atomes, appelée transmutation, nécessite des apports d'énergie beaucoup plus importants faisant l'objet des réactions nucléaires.
La composition chimique d'une molécule est donnée par sa formule chimique. Exemples :
- la molécule de méthane CH4 est constituée d'un atome de carbone (C) et de quatre atomes d'hydrogène (H) ;
- la molécule de dioxygène O2 est constituée de deux atomes d'oxygène (O).
Histoire[modifier | modifier le code]
Le nom « molécule » provient du latin scientifique molecula, diminutif du nom latin moles, se traduisant par « masse ».
Le concept de molécule, sous sa forme actuelle, a été présenté la première fois en 1811 par Avogadro, qui a su surmonter la confusion faite à cette époque entre atomes et molécules, en raison des lois des proportions définies et multiples de John Dalton (1803-1808).
L'analyse d'Avogadro a été acceptée par beaucoup de chimistes, à des exceptions notables (Boltzmann, Maxwell, Gibbs). Mais l'existence des molécules est restée en discussion ouverte dans la communauté scientifique jusqu'au travail de Jean Perrin (1911) qui a alors confirmé expérimentalement l'explication théorique du mouvement brownien en termes d'atomes proposée par Einstein (1905). Jean Perrin a également recalculé le nombre d'Avogadro par plusieurs méthodes.
Types particuliers de molécules[modifier | modifier le code]
- L'étude des composés biochimiques a conduit les chimistes à distinguer les molécules organiques et inorganiques. En 2011, il existe près de 10 millions de composés organiques connus (composés dont un des éléments chimiques constitutifs est le carbone), soit plus de 25 fois le nombre de molécules inorganiques[2].
- Une molécule élémentaire ou homonucléaire est une molécule constituée d'un seul type d'atomes, par exemple le dioxygène (O2). Lorsqu’une molécule est composée de plusieurs types d’atomes, elle est dite hétéronucléaire.
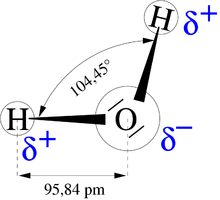
- Une molécule polaire ou apolaire est respectivement une molécule ayant un moment dipolaire résultant non nul (cas de la molécule d'eau) ou nul.
- Une molécule hydrophile ou hydrophobe est une molécule qui a de l'affinité pour l'eau ou qui fuit l'eau (non soluble ou non miscible avec l'eau), respectivement ; comme l'acide oléique, molécule hydrophobe qui fuit donc l'eau.
- Une molécule amphiphile est une molécule ayant une ou plusieurs parties hydrophiles et une ou plusieurs parties hydrophobes.
- En appliquant strictement la définition, les ions polyatomiques ne sont pas des molécules. En revanche, les zwitterions, globalement neutres mais possédant des charges de signe opposé dans différentes parties de leur structure, sont des molécules.
- Une molécule marquée est une molécule dans laquelle un ou plusieurs atomes sont remplacés par un de leurs isotopes. Cette pratique est courante avec des isotopes radioactifs, dans un but médical.
- Une molécule activée (ou excitée) est une molécule qui contient un ou plusieurs atomes excités, atomes dont un ou plusieurs électrons se trouvent à des niveaux d'énergie plus élevés que celui de l'état fondamental.
- Deux molécules sont dites isoélectroniques si elles ont la même configuration électronique de valence.
- Molécule médicamenteuse : on appelle abusivement molécule la substance active d'un médicament (par opposition à son nom de marque), quand bien même la substance active est composée de plusieurs espèces chimiques différentes (exemple : cas de la gentamicine). Il est préférable de parler de substance active ou de principe actif.
Caractéristiques[modifier | modifier le code]
Ordonnancement[modifier | modifier le code]
Les molécules d'un corps sont en agitation permanente (sauf au zéro absolu). Cette agitation, appelée mouvement brownien, a été décrite la première fois par Robert Brown en 1821 dans les liquides (mais expliquée presque 100 ans plus tard).
- À l'état gazeux, les molécules sont très espacées, très agitées, avec des mouvements désordonnés provoqués par les chocs entre elles ou avec les parois (les corps solides avec lesquels elles sont en contact).
- À l'état liquide, l'espace entre les molécules est beaucoup plus restreint, et l'agitation beaucoup plus lente.
- À l'état solide, les molécules sont rangées selon un empilement, régulier ou non, et vibrent autour d'une position moyenne.
La température d'un corps donne une indication du degré d'agitation des molécules.
Les forces d'interaction de très faible intensité qui s'exercent à distance entre les molécules, appelées forces de van der Waals, conditionnent ces arrangements et par conséquent les propriétés physiques des composés moléculaires.
Ainsi, par exemple, les propriétés physiques exceptionnelles de l'eau sont dues pour beaucoup aux liaisons hydrogène.
Stabilité[modifier | modifier le code]
Les molécules sont des ensembles a priori électriquement neutres, dans lesquels les atomes sont liés entre eux majoritairement par des liaisons covalentes (il existe de nombreux exemples d'assemblages supra-moléculaires par liaisons de type van der Waals, hydrogène ou ionique), où apparaissent parfois des dissymétries électroniques pouvant aller jusqu'à donner des ions par solvatation (solvants polaires). Dès lors, on doit conclure que le dihydrogène (H2), le dichlore, le difluor et tant d'autres gaz diatomiques, sont électriquement neutres. Ce qui laisse entendre que lorsqu'ils sont isolés, ils sont zérovalents, pour respecter l'équivalence qu'il doit y avoir dans toute équation équilibrée en charges et globalement neutre comme : 2 H2 + O2 = 2H2O. Ici, dans la partie des réactifs, le dihydrogène et le dioxygène sont des molécules isolées et donc n'ont pas de charge propre, comme H2O (bien que molécule polaire). L'équation chimique vérifie donc la neutralité de la charge globale.
La forme et la taille d'une molécule (ou de l'une de ses parties) peut jouer un rôle dans son aptitude à réagir. La présence de certains atomes ou groupes d'atomes à l'intérieur d'une molécule joue un rôle majeur dans sa capacité à se rompre ou à fixer d'autres atomes issus d'autres corps, c’est-à-dire à se transformer pour donner naissance à d'autres molécules.
Les différents modes de représentation des molécules sont destinés à expliciter les différents sites réactifs ; certains enchaînements d'atomes, appelés groupes fonctionnels, produisent ainsi des similitudes de propriétés, tout particulièrement dans les composés organiques.
Macromolécules et polymères[modifier | modifier le code]
Les molécules possédant au moins plusieurs dizaines d'atomes sont appelées macromolécules ou polymères.
Exemples :
- les protéines, les lipides, les sucres, les acides nucléiques tels l'ADN et autres biomolécules de grandes tailles sont également des macromolécules où la grande variété des liaisons chimiques internes induit une réactivité chimique souvent très sélective jouant un rôle majeur dans l'activité biologique des êtres vivants ;
- les polyoléfines telles le polyéthylène (polymère synthétique) sont constituées d'enchaînements -C-C- ; le nombre d'atomes de carbone des chaînes peut atteindre plusieurs dizaines de milliers (correspondant à un degré de polymérisation élevé), d'où des propriétés physiques particulières.
Corps non moléculaires[modifier | modifier le code]
On distingue quatre catégories de substances non moléculaires :
- les gaz nobles (à l'état gazeux, liquide ou solide) qui, ayant une couche de valence saturée, ne se composent que d'atomes indépendants (ce sont des substances monoatomiques). À l'état condensé (liquide ou solide), la cohésion de l'ensemble est assurée par les forces de London ;
- les gaz d'autres corps simples, monoatomiques à très haute température (à des températures inférieures ils sont généralement moléculaires) ;
- les métaux (à l'état gazeux, liquide ou solide), purs ou en alliage. À l'état condensé (liquide ou solide), les atomes sont liés les uns aux autres par la mise en commun globale et délocalisée d'électrons (liaison métallique), mais sans formation de petits groupes. Les métaux solides forment une structure tridimensionnelle appelée réseau métallique ;
- les composés ioniques (ou sels) à l'état solide ou liquide, qui regroupent des cations et des anions c'est-à-dire des éléments portant une charge positive (cations) ou négative (anions). La cohésion de l'ensemble est assurée par la force électrostatique qui attire les ions ayant des charges électriques de signes opposés (liaison ionique). Lorsqu'un ion n'est pas monoatomique mais constitué d'un groupe d'atomes doté d'une charge globale non nulle, on parle d'ion polyatomique (ou moléculaire). Les sels solides forment une structure tridimensionnelle appelée réseau ionique ;
- les réseaux covalents solides, qui sont des composés covalents non moléculaires comme le diamant, le graphite, le graphène ou encore le dioxyde de silicium. Ce sont des structures covalentes géantes, créant un réseau tridimensionnel comparable aux structures des réseaux métalliques ou ioniques.
Dans le milieu interstellaire[modifier | modifier le code]
Dans les régions entre des systèmes solaires, la probabilité de rencontre entre atomes est très faible, mais il existe des assemblages moléculaires, tels que le dihydrogène, le monoxyde de carbone ou encore certains fullerènes. Les comètes et les atmosphères gazeuses des planètes contiennent une plus grande variété de molécules.
Niveau moléculaire[modifier | modifier le code]
La structure des organismes biologiques qui constituent la biosphère peut être décomposée en plusieurs niveaux d'organisation : atomique, moléculaire, cellulaire, tissulaire, organique, des systèmes nerveux, et enfin celui de l'organisme dans sa totalité fonctionnelle.
L'étude scientifique du vivant se fait par des recherches sur les éléments de chacun de ces niveaux, puis par la compréhension des interactions entre ces différents niveaux (voir l'article Méthode scientifique).
L'étude du niveau des molécules permet de comprendre le fonctionnement de la cellule, qui est l'unité fonctionnelle élémentaire du vivant.
Notes et références[modifier | modifier le code]
- (en) Entrée « molecule », (DOI 10.1351/goldbook.M04002), d'après IUPAC (compilé par Alan D. McNaught et Andrew Wilkinson), Compendium of chemical terminology : IUPAC recommendations (the Gold Book) [« Compendium de terminologie chimique : recommandations IUPAC »], Oxford, Blackwell science, (réimpr. 2000), 2e éd. (1re éd. 1987), VIII-450 p., 28 cm (ISBN 0-8654268-4-8 et 978-0-8654268-4-9).
- (en) Raymond L. Neubauer, Evolution and the Emergent Self: The Rise of Complexity and Behavioral Versatility in Nature, Columbia University Press, (lire en ligne), p. 259.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
- Représentation des molécules
- Réaction chimique
- Biologie moléculaire
- Stabilité moléculaire
- Chimie organique
- Molécule synthétique
- Stéréochimie | Énantiomère | Diastéréoisomère
- Modélisation moléculaire
- ADN, une molécule à la base de la vie
- Gastronomie moléculaire
Liens externes[modifier | modifier le code]
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Encyclopédie Vulgaris Médical : Atomes et molécules
- Site éducatif sur la chimie
- (en) ChEBI, la base de données de l'EMBL, sur les entités moléculaires.
